
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
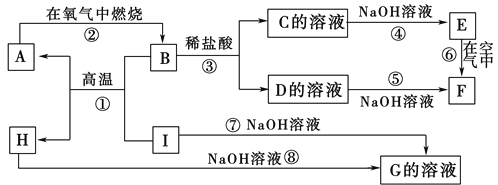
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是________。
(2)反应①的化学方程式为_____________________________________
反应③的离子方程式为________________________
反应⑧的化学方程式为_____________________________________
(3)反应⑥过程中的现象是______________________________。
(4)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占______L。
【答案】铁元素8Al+3Fe3O4 ![]() 4Al2O3+9FeFe3O4+8H+=2Fe3++Fe2+ +4H2OAl2O3+2NaOH=2NaAlO2+H2O生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色33.6
4Al2O3+9FeFe3O4+8H+=2Fe3++Fe2+ +4H2OAl2O3+2NaOH=2NaAlO2+H2O生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色33.6
【解析】
试题F是红褐色难溶于水的沉淀,因此F是氢氧化铁,则E是氢氧化亚铁,所以C和D分别是亚铁盐和铁盐。B和盐酸反应生成C和D,所以B是四氧化三铁,C是氯化亚铁,D是氯化铁,A在氧气中燃烧生成B,则A是铁。H和I均能与氢氧化钠溶液反应生成G,则I是铝,和四氧化三铁发生铝热反应生成铁和氧化铝,H是氧化铝,G是偏铝酸钠,据此分析解答。
解析:F是红褐色难溶于水的沉淀,因此F是氢氧化铁,则E是氢氧化亚铁,所以C和D分别是亚铁盐和铁盐。B和盐酸反应生成C和D,所以B是四氧化三铁,C是氯化亚铁,D是氯化铁,A在氧气中燃烧生成B,则A是铁。H和I均能与氢氧化钠溶液反应生成G,则I是铝,和四氧化三铁发生铝热反应生成铁和氧化铝,H是氧化铝,G是偏铝酸钠,则。
(1)根据以上分析可知A、B、C、D、E、F六种物质中所含的同一种元素的名称是铁。
(2)根据以上分析可知反应①的化学方程式为8Al+3Fe3O4 ![]() 4Al2O3+9Fe。反应③的离子方程式为Fe3O4+8H+=2Fe3++Fe2+ +4H2O;反应⑧的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O。
4Al2O3+9Fe。反应③的离子方程式为Fe3O4+8H+=2Fe3++Fe2+ +4H2O;反应⑧的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O。
(3)反应⑥是氢氧化亚铁被空气氧化,过程中的现象是生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色。
(4)根据8Al+3Fe3O4 ![]() 4Al2O3+9Fe可知1mol铝发生反应后生成
4Al2O3+9Fe可知1mol铝发生反应后生成![]() 铁,铁在高温下与足量的水蒸气反应的方程式为3Fe+4H2O(g)
铁,铁在高温下与足量的水蒸气反应的方程式为3Fe+4H2O(g)![]() 4H2+Fe3O4,所以生成的气体换算成标准状况下为
4H2+Fe3O4,所以生成的气体换算成标准状况下为![]() 。
。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.浓硫酸稀释、酸碱中和反应,均为放热反应
B.SiO2既能与NaOH溶液反应,又能与HF溶液反应,所以SiO2是两性氧化物
C.向某溶液中先加足量稀盐酸无明显现象,再加BaCl2溶液,若产生白色沉淀,则该溶液中一定含有![]()
D.某红棕色气体能使湿润的淀粉碘化钾试纸变蓝,说明该气体一定是NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbSO4的工艺流程如图:
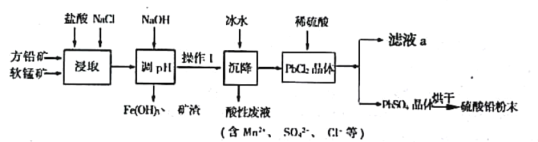
已知:
i.PbCl2 难溶于冷水,易溶于热水
ii.PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
iii.Ksp(PbSO4) =1.08×10-8,Ksp(PbCl2)=1.6×10-5
(1)“浸取”过程中盐酸与MnO2、PbS 发生反应生成PbCl2和S的化学方程式为___________________;
(2)沉降操作时加入冰水的作用是____________________________;
(3)20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是___________(填字母)
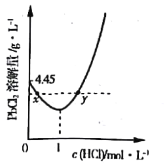
A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+) 不相等
C.当盐酸浓度为1mol·L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol·L-1时,随HCl浓度增大,PbCl2 溶解量减少是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(4)调pH的目的是_________________________________,操作I的方法是____________________;PbCl2“转化”后得到PbSO4,当c(Cl-)=0.100mol/L时,c(SO42-)=_________________________;
(5)滤液a经过处理后可以返回到__________________工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂—三盐基硫酸(3PbO·PbSO4·H2O),写出该反应的反应方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3过饱利溶液经结晶脱水可得Na2S2O5,三室膜电解技术可用于制备Na2S2O5,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。下列说法中正确的是
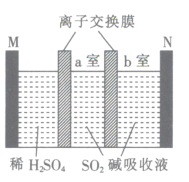
A.M为阴极
B.离子交换膜均为阴离子交换膜
C.阳极反应式为2H2O-4e-=4H++O2↑
D.最后在b室生成Na2S2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼在冶金、核工业、农业、高新材料等方面都有重要的应用,一种利用硼镁矿制取粗研的工艺流程:

已知:硼镁矿的主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7)·10H2O。
回答下列问题:
(1)硼镁矿要粉碎处理,其目的是_______,NaOH浓溶液与硼镁矿反应的化学方程式为__________________________________(不考虑杂质参与反应)。
(2)实验室过滤操作中要用到的玻璃仪器包括烧杯、_______、______。洗涤沉淀的操作方法为_____________________________________。
(3)试解释流程中生成无水MgCl2需在HCl氛围中进行的原因:___________________。
(4)已知H3BO3为一元弱酸,其与NaOH反应的化学方程式为NaOH+H3BO3=Na[B(OH)4],写出H3BO3的电离方程式:_________________________________________。
(5)实验测得一定质量的H3BO3在不同温度下分解的曲线如图所示。图中A、B、C、D点对应得到的物质都为纯净物。
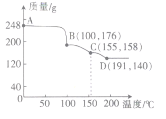
①C对应的物质可表示为2B2O3·nH2O,则n=_______
②写出C到D过程中发生反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废报纸中富含纤维素,因其量大且价廉易得,可以进行资源化利用。某实验小组对废报纸再利用的部分转化设计过程如下图所示:
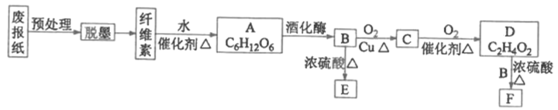
已知E是式量小于30的烃,且是一种果实催熟剂: F是具有果香味的液体.
(1)A的名称是_________; B中官能团的结构简式为_______;
(2)E发生加聚反应的化学方程式为_________;
(3)D→F的反应类型为____;
(4)已知实验室制取少量F时常用饱和碳酸钠溶液吸收。实验结束后分离F和饱和碳酸钠溶液时用到的主要玻璃仪器是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为构成细胞的部分元素及化合物(其中a、b、c、d代表小分子物质,X,Y,Z代表大分子物质,C、H、O、N、P代表化学元素)。请分析回答下列问题。
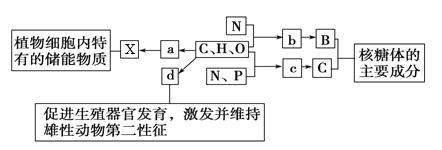
(1)物质a是________,检验物质a的常用试剂是_____。在动物细跑内,与物质X作用最似的物质是______。与物质X组成元素相同,在动物、植物细胞中均可含有的最理想的储能物质是______。
(2)物质b是________。若某种Y分子含有2条直链肽链,由18个b分子(平均相对分子质量为128)组成,则该Y分子的相对分子质量大约为______。
(3)物质c在人体细胞中共有________种,分子中________的不同决定了c的种类不同。
(4)物质d是________,d和________、维生素d都属于固醇类物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O俗名为“笑气”,也是一种温室气体。结合所学知识,回答下列问题:
(1)锌与极稀硝酸反应可生成N2O,该反应的化学方程式为___________,其中作氧化剂的硝酸与参与反应的硝酸的物质的量之比为___________。
(2)已知几种物质的相对能量如下:
物质 | N2O(g) | CO(g) | N2(g) | CO2(g) |
相对能量/kJmol-1 | 475.5 | 283.0 | 393.5 | 0 |
①N2O(g)和CO(g)反应生成N2(g)和CO2(g)的热化学方程式为____________。
②若其他条件不变,加入高效催化剂,该反应的焓变将_______(填“增大”、“减小”或“不变”)。
(3)碘蒸气能催化N2O的分解,反应历程(步骤)如下:
i.I2(g)2I(g)
ii.I(g)+N2O(g)=N2(g)+IO(g)
iii.2IO(g)+2N2O(g)=2N2(g)+2O2(g)+I2(g)
实验表明,在反应过程c(I)始终大于c(IO),由此推测,反应速率ii_________iii(填“>”、“<”或“=”)。
(4)一定温度下,向恒容密闭容器中充入2 mol N2O(g)和3 mol NO(g),发生反应:N2O(g)+NO(g)N2(g)+NO2(g) △H。测得N2体积分数与温度、时间的关系如图所示。
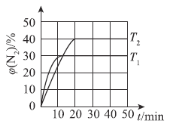
①△H___________0(填“>”、“<”或“=”)。
②下列情况表明该反应达到平衡状态的是___________(填字母)。
A.混合气体的密度不再改变 B.相对分子质量不再改变
C.NO和NO2的消耗速率相等 D.N2O的体积分数不再改变
③T1时,该反应的平衡常数K=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下两种等物质的量的可燃性气体共1.68L,其中一种是烃,在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g。则这两种混合气体可能为
A.H2与C4H6B.CO与C2H4C.CO与C3H6D.H2与C2H4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com