
 CO2 和CO与我们的社会生活联系相当密切,某化学课题组对此进行了探究.
CO2 和CO与我们的社会生活联系相当密切,某化学课题组对此进行了探究.分析 (1)若将0.1mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合,碳酸根离子水解程度大于碳酸氢根离子,离子浓度碳酸氢根离子浓度大于碳酸根离子浓度;根据原子守恒和电荷守恒计算c(OH-)-c(H+)的值;
(2)电离平衡常数指弱电解质在一定条件下电离达到平衡时,溶液中电离所生成的各种离子浓度系数次幂的乘积,跟溶液中未电离分子的浓度系数次幂的乘积的比值,则H2CO3?HCO3-+H+的平衡常数K=$\frac{c({H}^{+})c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$;
(3)依据溶液呈碱性,判断碳酸氢根离子水解程度大于电离程度分析判断离子浓度大小;
(4)根据CaCO3、BaCO3的溶度积大小可知BaCO3更难溶,因此令CO2生成BaCO3反应更完全;
(5)①两个反应靠O2联系起来,只要知道O2和另外任意一种气体的平衡浓度,均可求出混合气体的平衡组成;
②依据化学平衡计算平衡后得到氧气物质的量,结合反应过程画出变化曲线.
解答 解:(1)若将0.1mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合,碳酸根离子水解程度大于碳酸氢根离子,离子浓度c(CO32-)<c(HCO3-),根据原子守恒和电荷守恒计算c(OH-)-c(H+)的值,根据碳原子守恒得,c(CO32-)+c(HCO3- )+c(H2CO3)=0.1mol/L,根据溶液中电荷守恒得:2×c(CO32-)+c(HCO3- )+c(OH-)=c(Na+ )+c(H+ ),c(Na+ )=0.2mol/L,所以c(OH-)-c(H+)=c(HCO3- )+2c(H2CO3),
故答案为:小于;c(HCO3- )+2c(H2CO3);
(2)饱和CO2水溶液的pH=5.6,所以c(H+)=10-5.6=2.5×10-6mol/L,c(H2CO3)=1.5×10-5mol•L-1,
则H2CO3?HCO3-+H+的平衡常数,K=饱和CO2水溶液的pH=5.6,所以c(H+)=10-5.6=2.5×10-6mol/L,c(H2CO3)=1.5×10-5 mol•L-1,
则H2CO3?HCO3-+H+的平衡常数,K=$\frac{c({H}^{+})c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$=$\frac{2.5×10×2.5×1{0}^{-6}}{1.5×1{0}^{-5}}$=4.2×10-7 mol•L-1,
故答案为:4.2×10-7 mol•L-1;
(3)因NaHCO3溶液显碱性,HCO3-的水解程度大于自身的电离程度,即NaHCO3溶液中既存在电离平衡为HCO3-?CO32-+H+,水解平衡为HCO3-+H2O?H2CO3+OH-,而HCO3-水解程度大于电离程度,
故答案为:>;因为NaHCO3溶液中既存在电离平衡:HCO3-?CO32-+H+,又存在水解平衡:HCO3-+H2O?H2CO3+OH-,而HCO3-水解程度大于电离程度;
(4)根据CaCO3、BaCO3的溶度积大小可知BaCO3更难溶,因此令CO2生成BaCO3反应更完全,故可选择Ba(OH)2(或NaOH溶液和BaCl2溶液)作为CO2的沉淀剂,
故答案为:Ba(OH)2(或NaOH溶液和BaCl2溶液);
(5)①由两个方程式可知,两个反应靠O2联系起来,只要知道O2和另外任意一种气体的平衡浓度,均可求出混合气体的平衡组成,当知道H2O和H2或CO和CO2的平衡浓度时,由于两个方程式无法通过O2建立反应量的关系,所以无法求其混合气体的平衡组成,选项中B符合,
故答案为:B;
②图象分析可知,水反应物质的量2mol-0.75mol=1.25mol,
2H2O=2H2+O2
起始量(mol) 2 0 0
变化量(mol) 1.25 1.25 0.625
反应后量(mol)0.75 1.25 0.625
结合反应消耗氧气得到,
2CO+O2?2CO2
起始量(mol) 2 0.625 0
变化量(mol) 0.25 0.125 0.25
平衡量(mol) 1.75 0.5 0.25
最后平衡状态压强为0.5mol,图象为: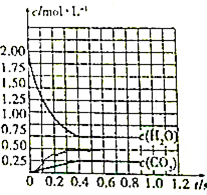 ,
,
故答案为: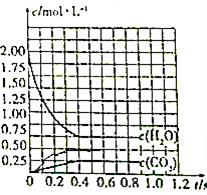 .
.
点评 本题考查化学平衡的影响因素分析和计算应用、弱电解质溶液中平衡影响因素分析和PH计算、平衡常数的计算、盐类水解、图象理解应用等知识,题目难度较大,试题知识点较多、综合性较强,充分考查学生的分析能力及化学计算能力,要求学生能根据题目所给信息解题,善于发掘题目信息.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液和盐酸 | B. | NaHCO3溶液和Ca(OH)2溶液 | ||
| C. | Ba(OH)2溶液和浓MgCl2溶液 | D. | 稀硫酸和碳酸氢钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 12.5% | C. | 17.5% | D. | 25% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
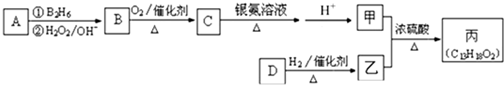
 -CH=CHCHO
-CH=CHCHO -CH2CH2CH2OH
-CH2CH2CH2OH (CH3)2CHCOOCH2CH2CH2-
(CH3)2CHCOOCH2CH2CH2- +H2O
+H2O查看答案和解析>>
科目:高中化学 来源: 题型:实验题
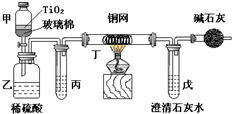 电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质 | |
| D. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)═c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.75 mol•L-1 | B. | 1.5 mol•L-1 | C. | 2 mol•L-1 | D. | 0.15 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化不一定都是化学反应 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 在一个确定的化学反应关系中,反应物的总能量总是大于生成物的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com