
| A. | v(A)=0.01 mol/(L•s) | B. | v(B)=0.02 mol/(L•s) | C. | v(B)=0.60mol/(L•s) | D. | v(C)=0.5mol/(L•s) |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,注意单位保持一致.
解答 解:不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,
A.$\frac{v(A)}{1}$=0.01 mol/(L•s);
B.$\frac{v(B)}{3}$=0.0067 mol/(L•min);
C.$\frac{v(B)}{3}$=0.2 mol/(L•s);
D.$\frac{v(C)}{2}$=0.5 mol/(L•s);
故选D中表示的速率最快,
故选D.
点评 本题考查化学反应速率快慢比较,比较基础,利用比值法可以快速判断,也可以转化为同一物质表示的速率进行比较.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | K | F | |||||
| 3 | A | C | D | I | G | R | ||
| 4 | B | H |
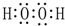 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .⑦的电子式为
.⑦的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.01mol/(L•S) | B. | v(B)=0.02mol/(L•S) | C. | v(B)=0.60mol/(L•S) | D. | v(C)=1.0mol/(L•S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
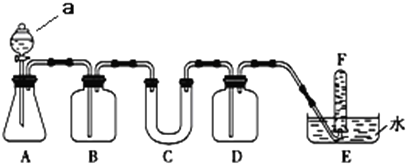
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | Na2O2 | 与CO2及水蒸气反应,产生O2 |
| D | . |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化产物与还原产物粒子个数比是2:5 | |
| B. | 被氧化的盐酸占参加反应盐酸总数的$\frac{5}{8}$ | |
| C. | KMnO4只有一部分发生还原反应 | |
| D. | KMnO4与HCl恰好分别完全发生还原反应和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
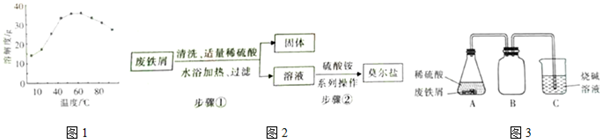
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
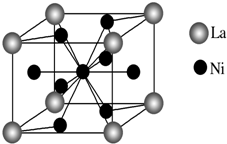 金属镍及其化合物在合金材料以及催化剂等方面应用广泛,请回答下列问题.
金属镍及其化合物在合金材料以及催化剂等方面应用广泛,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Na+、Cl-、CO32- | B. | Fe2+、NO3-、Na+、Cl- | ||
| C. | NH4+、K+、AlO2-、SiO32- | D. | Cu2+、NH4+、SO42+、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com