
(17分)铁及其化合物应用广泛。
(1)三氯化铁是一种水处理剂,工业制备无水三氯化铁固体的部分流程如下图:
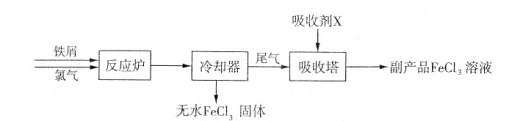
①检验副产品中含有X时,选用的试剂是 (填下列各项中序号)。
a.NaOH溶液 b.KSCN溶液 c.酸性KMnO4溶液 d.铁粉
②在吸收塔中,生成副产品FeCl。的离子方程式为
(2)高铁酸钾(K2FeO4)也是一种优良的水处理剂,工业上,可用铁作阳极,电解KOH溶液制备高铁酸钾。电解过程中,阳极的电极反应式为 ;电解一段时间后,若阳极质量减少28 g,则在此过程中,阴极析出的气体在标准状况下的体积为 L。
(3)硫化亚铁常用于工业废水的处理。
①你认为,能否用硫化亚铁处理含Cd2+的工业废水? (填“能”或“否”)。请根据沉淀溶解平衡的原理解释你的观点(用必要的文字和离子方程式说明):
(已知:25℃时,溶度积常数Ksp(FeS)=6.3×10-18、Ksp(CdS)=3.6×10-29)
②工业上处理含Cd2+废水还可以采用加碳酸钠的方法,反应如下:2Cd2++2CO32-+H2O===Cd2(OH)2CO3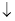 +A。则A的化学式为 。
+A。则A的化学式为 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015浙江省高二下学期4月阶段性测试化学试卷(解析版) 题型:选择题
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器I、II、III,在I中充入1 mol CO和1 mol H2O,在II中充入1 mol CO2 和1 mol H2,在III中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器I、II、III,在I中充入1 mol CO和1 mol H2O,在II中充入1 mol CO2 和1 mol H2,在III中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器I、II中正反应速率相同
B.容器I、III中反应的平衡常数相同
C.容器I中CO 的物质的量比容器II中的少
D.容器I中CO 的转化率与容器II中CO2 的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列物质中属于同系物的是
①CH3CH2Cl ②CH2=CHCl ③CH3CH2CH2Cl ④CH2ClCH2Cl ⑤CH3CH2CH2CH3 ⑥CH3CH(CH3)2
A.①② B.①④ C.①③ D.⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱
B.漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同
C.将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀
D.向FeCl2溶液中通入C l2反应的离子方程式为:Fe2++Cl2=Fe3++2C1—
l2反应的离子方程式为:Fe2++Cl2=Fe3++2C1—
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列说法错误的是
A.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
B.葡萄糖注射液不能产生丁达尔效应现象,不属于胶体
C.淀粉、油脂、蛋白质都能水解,但水解产物不同
D.纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
桂皮酸、布洛芬和阿司匹林均为某些药物的有效成分,其结构简式如下:
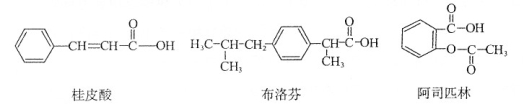
以下关于这三种有机物的说法中,不正确的是
A.都能与Na2CO3溶液反应产生CO2
B.一定条件下,均能与乙醇发生取代反应
C.只有桂皮酸可与溴的四氯化碳溶液发生加成反应
D.1 rnol阿司匹林最多能与l mol NaOH反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第二次模拟化学试卷(解析版) 题型:实验题
(14分)半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)

已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5,PCl3遇水会强烈水解生成 H3PO3和HCl。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为 。
(2)B中所装试剂是 ,E中冷水的作用是 F中碱石灰的作用是_____。
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后.通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入10.00 mL 0.1000 mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,假设测定过程中没有其他反应。根据上述数据,该产品中PC13的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省“江淮十校”高三4月联考理综化学试卷(解析版) 题型:选择题
下列各装置能够达到相应实验目的的是

A.用装置甲除去乙酸乙酯中混有的少量乙酸
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙制取无水MgCl2
D.用装置丁制取乙烯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通、扬州、连云港高三第二次调研测试化学试卷(解析版) 题型:简答题
(15分)氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4= kJ·mol-1。
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式: 。
②在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为: ;为抑制肼的分解,可采取的合理措施有 (任写一种)。
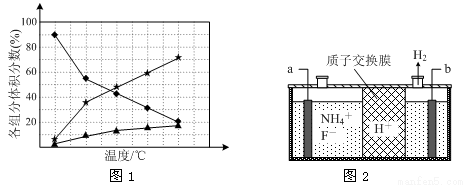
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
①氮化硅的化学式为 。
②a电极为电解池的 (填“阴”或“阳”)极,写出该电极的电极反应式: ;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com