
【题目】将5.32 g纯Fe溶于足量稀H2SO4中,在加热条件下用2.53 g KNO3去氧化溶液中的Fe2+,充分反应后余下的Fe2+还原0.009 mol Cl2才能完全氧化,则KNO3的还原产物中N的化合价是
A.–3B.+4C.+3D.+2
科目:高中化学 来源: 题型:
【题目】短周期元素![]() 在元素周期表中的相对位置如图所示,其中w原子的最外层电子数是最内层电子数的3倍.下列判断不正确的是
在元素周期表中的相对位置如图所示,其中w原子的最外层电子数是最内层电子数的3倍.下列判断不正确的是![]()

A.x与同主族且相邻元素的气态氢化物的沸点,前者高于后者
B.含Y元素的盐溶液有的显酸性,有的显碱性
C.x的气态氢化物与w的最高价氧化物的水化物反应只能生成一种盐
D.x与H、O元素形成的化合物可以组成一种盐,其中![]() 元素原子个数之比为2:4:3
元素原子个数之比为2:4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功合成了世界上首个五氮阴离子盐(H3O)3(NH4)4(N5)6Cl(用R代表),请根据其组成的元素和结构回答下列问题:
(1)氮原子价层电子的轨道表达式为_____________________。
(2)第一电离能N______O(填“>”、“<”或“=”),其原因是_____________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如下图所示。
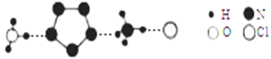
①R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
a.中心原子的杂化轨道类型 b.中心原子的价层电子对数
c.立体结构 d.共价键类型
②R中阴离子N5-中的σ键总数为________个。大π键可用符号πmn表示,其中m为形成大π键的原子数,n为形成大π键的电子数,则N5-中的大π键应表示为__________。
③图中虚线代表氢键,其表示式为(NH4+)NH…Cl、___________、____________。
(4)提取炼铜的阳极泥中金、银、铂时,用到王水(HNO3和HCl的物质的量之比为1∶3的混酸),过程如下:
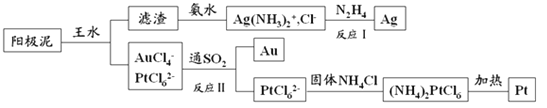
①滤渣的成分是_____________,(NH4)2PtCl6中配体是_______________________。
②金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,该反应的平衡常数很小,几乎不反应,但金却可以溶于王水,原因是____________________,试写出该反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,需要提纯后才能综合利用,粗盐精制的实验流程如下。
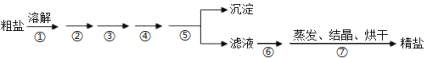
(1)下列说法不正确的是(__________)
A.在第①步中使用玻璃棒搅拌可加速粗盐溶解
B.第⑤步操作是过滤
C.在第②③④⑥步通过加入化学试剂除杂,加入试剂顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→稀盐酸
D.除去MgCl2的离子方程式为:Mg2++2OH=Mg(OH)2↓
(2)判断SO42-已除尽的方法是___。
(3)电解精制NaCl溶液可得到NaOH、Cl2和H2,它们是重要的化工原料。有关反应关系如图所示:(部分反应条件和物质省略)
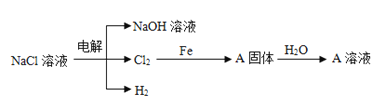
①Cl2与NaOH溶液反应可以制取“84”消毒液,发生反应的离子方程式为:__。
②写出Cl2和铁反应化学方程式,并用双线桥标出电子转移的方向和数目:__,标准状况下,22.4LCl2与足量的Fe反应,则反应过程中转移__个电子。
(4)向足量A溶液中加入少量的钠完全反应前后A溶液质量变化__(填“增大”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.80mol·L-1的NaOH溶液475mL和0.40mol·L-1的稀硫酸500mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是__(填序号),配制上述溶液还需用到的玻璃仪器是__(填仪器名称)。
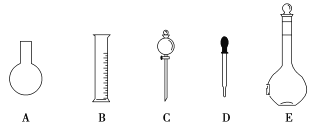
(2)根据计算用托盘天平称取NaOH的质量为__g,所需质量分数为98%、密度为1.84g·cm-3的浓硫酸的体积为___mL(计算结果保留一位小数)。
(3)在配制过程中,其他操作都准确,下列操作错误且能使所配溶液浓度偏高的有___(填代号)。
①用量筒量取浓硫酸时仰视读数
②洗涤量取浓硫酸后的量筒,并将洗涤液转入容量瓶中
③未等稀释后的硫酸溶液冷却至室温就转入容量瓶内
④将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
⑤定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑥转移前,容量瓶中含有少量蒸馏水
⑦定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
⑧定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SiO2+2C![]() Si+2CO↑;Si+C
Si+2CO↑;Si+C![]() SiC。
SiC。
现有石英砂和炭粉的混合物1mol,于高温下在电炉里充分反应后,得残留固体;
若石英砂与混和物的物质的量之比n(0<n<1),试讨论n取何值时,残留物的成分及其物质的量。
n | 例︰n= | _______ | _______ | _______ | _______ |
残留固体 | Si | _______ | _______ | _______ | _______ |
物质的量(摩) |
| _______ | _______ | _______ | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BF3与一定量的水形成(H2O)2·BF3,一定条件下(H2O)2·BF3可发生如图转化,下列说法中正确的是
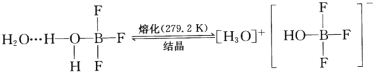
A.(H2O)2·BF3熔化后得到的物质属于离子晶体
B.(H2O)2·BF3分子间存在着配位键和氢键
C.BF3是仅含极性共价键的非极性分子
D.基态B原子核外电子的空间运动状态有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合元素周期表,回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图 1 中用实线补全元素周期表 的边界____________
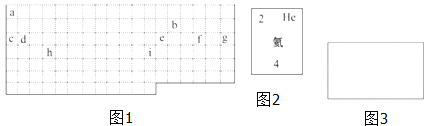
(2)表中所列元素,属于短周期元素的有____________;属于主族元素的有____________;g 元素位于第____________ 周期____________ 族;i 元素位于第____________ 周期____________族.
(3)元素 f 是第_______周期、第_______ 族元素,请在如图 3 所示的方框中按 氦元素(图 2)的式样写出该元素的原子序数、元素符号、元素名称、相对原子 质量_______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com