
【题目】高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。其中铁元素的化合价为
A. +2B. +5C. +6D. +8
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案科目:高中化学 来源: 题型:
【题目】已知酸式盐NaHB在水溶液中存在下列变化:①NaHB===Na++HB-,②HB-![]() H++B2-,③HB-+H2O
H++B2-,③HB-+H2O![]() H2B+OH-,且溶液中c(B2-)>c(H2B),则下列说法一定正确的是( )
H2B+OH-,且溶液中c(B2-)>c(H2B),则下列说法一定正确的是( )
A. 0.01 mol·L-1的NaHB溶液,其pH可能为2
B. NaHB及H2B均为强电解质
C. 该酸式盐溶液中水电离出的氢离子浓度小于纯水中水电离出的氢离子浓度。
D. HB-的电离程度小于HB-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能一步实现的是( )
A.Na2SiO3→H2SiO3B.H2SiO3→SiO2
C.SiO2→H2SiO3D.SiO2→Na2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂和蛋白质是生命活动所必需的营养物质。下列叙述正确的是
A.植物油不能发生水解反应B.葡萄糖能发生氧化反应和水解反应
C.淀粉水解的最终产物是葡萄糖D.蛋白质遇浓硫酸变为黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4· 2H2O)是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
I、制备草酸亚铁晶体:
①称取硫酸亚铁铵晶体5 g,放入250 mL三颈烧瓶中,加入10滴左右1.0 mol/LH2SO4溶液和15 mL蒸馏水加热溶解;
②加入25 mL饱和草酸溶液,加热搅拌至沸,停止加热,静置;
③待黄色晶体FeC2O42H2O沉淀后倾析,洗涤,加入约20 mL蒸馏水搅拌并温热5 min,静置,弃去上层清液,即得黄色草酸亚铁晶体。
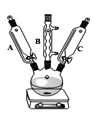
回答下列问题:
(1)仪器C的名称是____________;仪器B的作用是_____________
(2) 硫酸亚铁铵晶体用硫酸溶解的原因是____________________
(3)硫酸亚铁铵晶体可能混有一定Fe3+,羟胺(NH2OH,酸性条件下以NH3OH+形式存在)具有强还原性,可用羟胺去除亚铁盐中的Fe3+。写出相关的离子方程式____________________。
II、探究草酸亚铁的纯度:
①准确称取m g草酸亚铁固体样品(含有草酸铵杂质),溶于25 mL 2 mol/LH2SO4溶液中,在60~80℃水浴加热,用100 mL容量瓶配成100.00 mL溶液;
②取上述溶液20.00 mL,用KMnO4标准溶液(浓度为c mol/L)滴定三次,平均消耗V1 mL;
③加入适量锌粉和2 mL 2 mol/L H2SO4溶液,反应一段时间后,取1滴试液放在点滴板上检验,至Fe3+极微量;
④过滤除去锌粉,滤液收集在另一个锥形瓶中,将滤纸及残余物充分洗涤,洗涤液并入滤液中,再补充约2~3 mL 2 mol/L H2SO4溶液,继续用KMnO4标准溶液(浓度为c mol/L)滴定至终点,共平行测定三次,平均消耗V2 mL。
回答下列问题:
(4)在②中溶液中发生MnO4-+8H++5Fe2+=5Fe3++Mn2++4H2O,还有另一氧化还原反应,写出其离子方程式_____________用KMnO4标准溶液滴定至终点的现象是______________。
(5)计算m g固体样品的纯度为_____________(用含c、V1、V2的式子表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T℃时,向2.0 L恒容密闭容器中充入2.08 mol PCl5,反应PCl5(g) ![]() PCl3(g) + Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g) + Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 50 | 150 | 250 | 350 |
n(PCl3) / mol | 0 | 0. 56 | 0. 75 | 0. 80 | 0. 80 |
回答下列问题:
(1)反应在前50 s 的平均速率v(PCl3)= _______mol/( L·s) 。
(2)T℃时,起始时向容器中充入1. 2 mol PCl5、0. 40 mol PCl3 和0. 20 mol Cl2,反应达到平衡前v(正)__________(选填“>”、“=”或“ <”)v(逆) 。
(3)T℃时,若起始时向容器中充入6. 0 mol PCl3 和6. 0 mol Cl2,达到平衡时,平衡混合气体中PCl5的体积分数为多少?(写出解题过程)。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装 置的开关时,观察到电流表的指针发生了偏转。
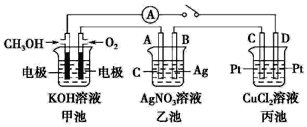
请回答下列问题:
(1)甲池为原电池,通入 CH3OH 电极的电极反应为________。
(2)乙池中A(石墨)电极的名称为_____(填“正极”“负极”或“阴极”“阳极”),总反应为_____。
(3)当乙池B极质量增加 5.4 g 时,甲池中理论上消耗 O2 的体积为_____mL(标准状况),丙池D极析出_____g 铜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I的形式存在,几种粒子之间的转化关系如图所示。已知淀粉遇单质碘变蓝,下列说法中正确的是

A. 向含I的溶液中通入Cl2,所得溶液加入淀粉溶液一定变蓝
B. 途径II中若生成1 mol I2,消耗1 mol NaHSO3
C. 氧化性的强弱顺序为Cl2>I2>IO3
D. 一定条件下,I与IO3可能生成I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算下列粒子的粒子数目。
(1) 0.3 mol H2O分子中所含氢原子数与________个NH3分子中所含氢原子数相等。
(2) 12 g 乙烷中所含共价键的物质的量是________。
(3)分子数为0.5NA的CO2分子,质量是________。
(4) 9.5 g A分子的物质的量是0.25 mol ,A的摩尔质量是________,N个B分子的质量是m g,则B的摩尔质量是________,24 g O3中的分子数与________g 18O2中的分子数相等。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com