
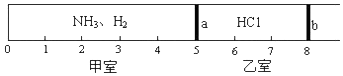
分析 (1)根据阿伏加德罗定律,同温同压下,气体的体积比等于物质的量之比,再根据甲室中气体的物质的量和质量计算氨气和氢气的物质的量之比;
(2)根据剩余气体的物质的量计算剩余气体所占体积,从而确定b的位置
解答 解:(1)甲室气体与乙室气体的体积比为5:3,且是同温同压,根据阿伏加德罗定律,可知甲室气体的总物质的量为0.6mol×$\frac{5}{3}$=1mol,
设氨气的物质的量为x,氢气的物质的量为y,
根据其物质的量、质量列方程组为:
$\left\{\begin{array}{l}{x+y=1}\\{17x+2y=11}\end{array}\right.$,解得:$\left\{\begin{array}{l}{x=0.6}\\{y=0.4}\end{array}\right.$,所以氨气和氢气的物质的量之比=0.6mol:0.4mol=3:2,
故答案为:3:2;
(2)甲室中NH3的物质的量为1.0mol×3/5=0.6mol,恰好等于HCl的物质的量,所以二者恰好完全反应生成NH4Cl固体,剩余H2的物质的量为0.4mol,相同条件下,气体的体积之比等于其物质的量之比,所以活塞b将会左移至“2”处,故答案为:2.
点评 本题考查了阿伏伽德罗定律及其推论,明确相同条件下,气体的体积与其物质的量之间的关系是解本题关键,并结合基本公式来分析解答,难度中等.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 3种溶液pH的大小顺序是③>②>① | |
| B. | 若将3种溶液稀释相同倍数,pH变化最大的是② | |
| C. | 若分别加入25 mL 0.1 mol/L盐酸后,pH最大的是① | |
| D. | 3种溶液中,由水产生的c(H+)大小顺序是①>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、K+、SO42-、CO32- | B. | Na+、NO3-、Ac-、K+ | ||
| C. | Al3+、Na+、Cl-、SO42- | D. | Na+、K+、MnO4-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为河虾中含有砷元素,所以不能食用 | |
| B. | “两者同食”发生的反应中维生素C作氧化剂 | |
| C. | 五价砷在维生素C作用下发生了还原反应 | |
| D. | 已知砒霜的主要成分是氧化砷,可以推测所含的砷元素化合价为+5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过蒸馏,分离苯和硝基苯的混合物 | |
| B. | 电解AlCl3,可得金属铝 | |
| C. | 将MgCl2溶液蒸干,可得无水MgCl2 | |
| D. | 用过滤的方法,从碘水中提取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)①NH3②SO3③Cl2④BaSO4⑤酒精 ⑥CH3COONH4⑦HClO⑧Cu
(1)①NH3②SO3③Cl2④BaSO4⑤酒精 ⑥CH3COONH4⑦HClO⑧Cu查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol Na与足量O2反应,生成Na2O和Na2O2 的混合物,钠失去电子数为NA | |
| B. | 常温常压下,32gO2 和O3 的混合气体所含原子数为2NA | |
| C. | 22.4LCl2含有的原子数为2NA | |
| D. | 标准状况下,1molFe与22.4LCl2充分反应,转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:H2SiO4<H2CO3<H3PO4 | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:F->Cl->I- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com