
分析 (1)氧化产物为氯气,还原产物为MnCl2,二者物质的量之比为5:2,在根据m=nM计算质量之比;
(2)被氧化的HCl生成氯气,根据电子转移守恒计算被氧化HCl物质的量,再根据氯原子守恒计算氯气物质的量,根据V=nVm计算氯气体积.
解答 解:(1)氧化产物为氯气,还原产物为MnCl2,二者物质的量之比为5:2,二者质量之比为5mol×71g/mol:2mol×126g/mol=355:252,
故答案为:355:252;
(2)被氧化的HCl生成氯气,根据电子转移守恒,被氧化HCl物质的量为$\frac{20mol}{0-(-1)}$=20mol,根据氯原子守恒,生成氯气物质的量为$\frac{20mol}{2}$=10mol,标况下氯气体积为10mol×22.4L/mol=224L,
答:论上被氧化的HCl物质的量为20mol,标况下生成氯气的体积为224L.
点评 本题考查氧化还原反应计算,比较基础,根据化合价理解氧化还原反应基本概念,(2)注意利用守恒法计算解答.


科目:高中化学 来源: 题型:选择题
| A. | SO2能漂白纸浆等,故可广泛用于食品的漂白. | |
| B. | 烹调鱼时加入少量料酒和食醋可以减少腥味、增加香味 | |
| C. | 工业上用电解熔融的AlCl3来制取铝单质 | |
| D. | 制作航天服的聚酯纤维和用于光纤通信的光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c=$\frac{W•1000•ρ}{M}$ | B. | m=V•ρ•$\frac{W}{100}$ | C. | W%=$\frac{c×M}{1000×ρ}$% | D. | c=$\frac{m}{V•M}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
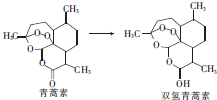
| A. | 青蒿素中氧元素的质量为80g | B. | 双氢青蒿素能发生酯化反应 | ||
| C. | 双氢青蒿素能与溴水发生加成反应 | D. | 青蒿素和双氢青蒿素均含羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5 | |
| C. | ①与③等体积混合后溶液PH为a,②与④等体积混合后溶液PH为b.则a>b | |
| D. | 1ml③和100ml④分别与足量金属镁反应,产生的H2一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 流出溶液的体积为(m-n) mL | B. | 流出溶液的体积为(n-m) mL | ||
| C. | 管内溶液体积等于(a-n) mL | D. | 管内溶液体积多于n mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 得电子越多,其氧化性越强 | |
| B. | 阳离子只有氧化性,阴离子只有还原性 | |
| C. | 要完成SO32-→SO42-的转化,必须加入氧化剂 | |
| D. | 金属活动顺序表中,排在前面的金属阳离子的氧化性强于排在后面的金属阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应 | |
| C. | 氯气具有漂白性 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com