


科目:高中化学 来源: 题型:
| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A、4个 | B、3个 | C、2个 | D、1个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol?L-1 H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
如图是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol?L-1 H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>②>③>④ |
| B、②>①>④>③ |
| C、③>④>①>② |
| D、④>③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的 |
| A | 溴乙烷在氢氧化钠存在下加热水解后,加入硝酸银溶液 | 可检验溴元素的存在 |
| B | 苯中有少量苯酚,加入浓溴水后,过滤 | 可除去苯中的苯酚 |
| C | 乙烷中有少量乙烯,通入酸性KMnO4溶液中 | 可除去乙烷中的乙烯 |
| D | 测苯与液溴反应前后的pH | 验证发生的是加成反应还是取代反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池中失去电子的一极为负极 |
| B、电解池中与直流电源负极相连的一极为阴极 |
| C、原电池中相对活泼的一极为正极 |
| D、电解池中发生氧化反应的一极为阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、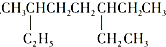 和 和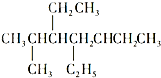 ,主链上碳原子数均为7个 ,主链上碳原子数均为7个 |
| B、主链含5个碳原子,有甲基、乙基2个支链的烷烃有三种 |
| C、新戊烷、正丁烷、异丁烷和丙烷的熔沸点依次降低 |
| D、C7H16的烷烃中,含有3个甲基的同分异构体有2种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com