
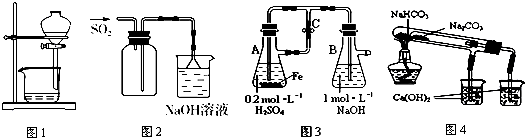
| A. | 图1用于放出碘的苯溶液 | |
| B. | 图2用于实验室收集SO2 | |
| C. | 图3用于实验室制备Fe(OH)2 | |
| D. | 图4用于比较NaHCO3和Na2CO3热稳定性 |
分析 A.碘和苯互溶,不能采用分液方法分离;
B.二氧化硫密度大于空气,应该采用向上排空气法收集;
C.Fe和稀硫酸反应生成硫酸亚铁,生成的氢气导致左边装置中压强增大致使硫酸亚铁溶液通过导管进入右边装置,硫酸亚铁和NaOH反应生成Fe(OH)2;
D.碳酸氢钠不稳定,受热易分解,碳酸钠较稳定,受热不易分解.
解答 解:A.碘和苯互溶,不能采用分液方法分离,应该采用蒸馏的方法分离,故A错误;
B.二氧化硫密度大于空气,应该采用向上排空气法收集,所以收集装置中导气管应该遵循“长进短出”原则,故B错误;
C.Fe和稀硫酸反应生成硫酸亚铁,生成的氢气导致左边装置中压强增大致使硫酸亚铁溶液通过导管进入右边装置,硫酸亚铁和NaOH反应生成Fe(OH)2且右边装置隔绝空气,防止氢氧化亚铁被氧化,故C正确;
D.碳酸氢钠不稳定,受热易分解,碳酸钠较稳定,受热不易分解,所以加热时碳酸钠受热温度应该高于碳酸氢钠,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生分析判断及实验操作能力,明确实验原理及物质性质是解本题关键,涉及物质分离和提纯、气体收集、物质制备等知识点,会根据物质形成差异性选取合适的分离提纯方法,注意C中制备氢氧化亚铁时要防止氢氧化亚铁被氧化.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 在反应①中,生成3mol汞,转移3mol电子 | |
| B. | 在反应②中,硫化汞既是氧化产物,又是还原产物 | |
| C. | 在反应③中,产生11.2L氧气,转移2mol电子 | |
| D. | 由反应③知,汞在空气中加强热会生成氧化汞 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无明显变化 |
| 3 | 向步骤2溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
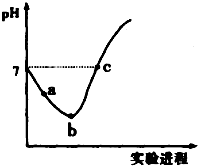 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1 的NaOH 溶液,整个实验进程中溶液的pH 变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1 的NaOH 溶液,整个实验进程中溶液的pH 变化曲线如图所示,下列叙述正确的是( )| A. | 向a 点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| B. | b 点所示的溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) | |
| C. | 由a 点到b 点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$ 减小 | |
| D. | c 点所示溶液中:c(Na+ )=2c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是配制一定物质的量浓度的溶液的专用仪器 | |
| B. | 容量瓶可以用来加热 | |
| C. | 能用容量瓶贮存配制好的溶液 | |
| D. | 可以用500mL容量瓶配制250mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放出218 kJ | B. | 放出109kJ | C. | 吸收218 kJ | D. | 吸收109 kJ1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com