
| A. | 2.4g金属镁与足量盐酸完全反应,失电子总数为0.2NA | |
| B. | 2NA个二氧化碳分子的质量为44g | |
| C. | 0.1mol/L NaCl溶液中,Na+与Cl-离子总数为0.1NA | |
| D. | 17g氨气中所含原子数为NA |
分析 A.2.4g镁的物质的量为0.1mol,0.1molMg完全反应生成0.2mol电子;
B.2NA个二氧化碳分子的物质的量为2mol,根据m=nM计算出2mol二氧化碳的质量;
C.缺少溶液体积,无法计算钠离子和氯离子的数目;
D.17g氨气的物质的量为1mol,含有4mol原子.
解答 解:A.2.4gMg的物质的量为:$\frac{2.4g}{24g/mol}$=0.1mol,0.1mol镁完全反应失去0.2mol电子,失电子总数为0.2NA,故A正确;
B.2NA个二氧化碳分子的物质的量为2mol,质量为:44g/mol×2mol=88g,故B错误;
C.没有告诉0.1mol/L NaCl溶液的体积,无法计算钠离子和氯离子的物质的量,故C错误;
D.17g氨气的物质的量为:$\frac{17g}{17g/mol}$=1mol,1mol氨气分子中含有1molN原子、3molH原子,总共含有4mol原子,所含原子数为4NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度不大,明确物质的量与阿伏伽德罗常数、摩尔质量之间的关系为解答关键,C为易错点,注意题中缺少溶液的体积.


科目:高中化学 来源: 题型:解答题

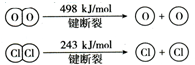
 ,反应A的热化学方程式是4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol.
,反应A的热化学方程式是4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰水共存物、空气、氨水、二氧化硫 | B. | 胆矾、盐酸、硫酸钠、干冰 | ||
| C. | 生铁、福尔马林、浓硫酸、碳酸钙 | D. | 碱石灰、漂白粉、氧化钠、硫酸钡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
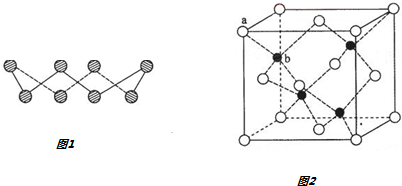
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子结构的行星模型 | B. | 勒夏特列原理 | ||
| C. | 洪特规则 | D. | 盖斯定理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散系的分类 | B. | 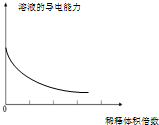 稀释浓氢氧化钠溶液的过程 | ||
| C. | 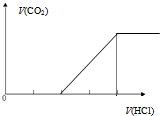 向碳酸钠溶液中逐滴滴加盐酸 | D. |  向偏铝酸钠溶液中逐滴滴加盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①是电离平衡 ②是水解平衡 | |
| B. | NaHCO3溶液呈碱性是因为①的程度大于② | |
| C. | 加入NaOH固体,①②平衡都向左移动 | |
| D. | 升高温度,①向右移动,②向左移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com