
 .
.分析 (1)根据结构式可以在一定程度上反映真正的分子结构和性质,甲烷分子中1个碳原子和4个氢原子分别形成1个碳氢共价键;
(2)根据取代反应原理写出甲烷与氯气反应生成四氯化碳的方程式;
(3)甲烷的同系物中,一氯取代物只有一种,说明该烷烃中只有一种等效氢原子,根据等效氢原子的判断方法来解答.
解答 解:(1)甲烷是碳原子和氢原子间通过共价单键形成的空间正四面体结构,其结构式为 ,故答案为:
,故答案为: ;
;
(2)1mol甲烷与4mol氯气发生取代反应生成四氯化碳和氯化氢,反应的化学方程式为CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl,故答案为:CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl;
(3)烷烃分子中,同一个碳上的氢原子等效,连在同一个碳原子上的氢原子等效,具有镜面对称的碳原子上的氢原子等效,烷烃的一氯取代物只有一种,说明该烷烃中只有一种等效氢原子,在碳原子数小于10的所有烷烃的同分异构体中,其一氯取代物只有一种的甲烷的同系物的结构简式为:CH3CH3、C(CH3)4和C(CH3)3C(CH3)3,
故答案为:CH3CH3、C(CH3)4(或C(CH3)3C(CH3)3).
点评 本题考查了甲烷的结构与性质、同分异构体的书写,题目难度中等,注意掌握甲烷的结构与性质,明确同分异构体的概念及书写原则,(3)为难点,需要明确等效H原子的含义及应用方法.


科目:高中化学 来源: 题型:选择题
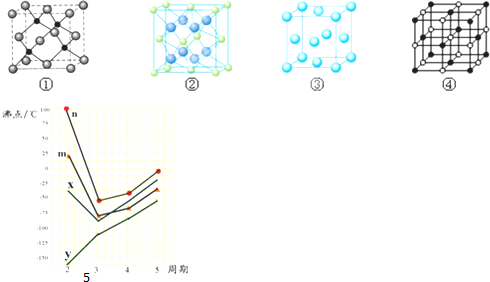
| A. | 若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y>X | |
| B. | 若8>m>3,则X必定为主族元素 | |
| C. | 若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为非极性分子 | |
| D. | 若a=b=3,8>m>n>b,则元素非金属性:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+H2O=HCl+HClO | B. | 2Na2O2+2H2O=4NaOH+O2? | ||
| C. | 2F2+2H2O=4HF+O2? | D. | 2Na+4H2O=2NaOH+H2? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
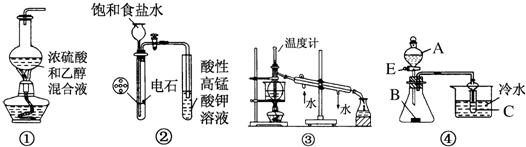
| A. | 图①用于实验室制乙烯 | |
| B. | 图②用于实验室制乙炔并验证乙炔发生氧化反应 | |
| C. | 图③用于实验室中石油的分馏 | |
| D. | 图④中若A为稀硫酸,B为纯碱(固体),C为苯酚钠溶液,则可验证硫酸、碳酸、苯酚酸性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若V1>V2,则说明HA的酸性比HB的酸性强 | |
| B. | 若V1>V2,则说明HA的酸性比HB的酸性弱 | |
| C. | 因为两种酸溶液的pH相等,故V1一定等于V2 | |
| D. | HA、HB分别和NaOH中和后,所得的溶液都一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E | F | |
| 主要化合价 | -1 | -3+5 | -2+6 | -1+7 | +2 | +1+2 |
| 原子半径nm | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
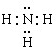 ,B的结构式为
,B的结构式为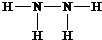 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
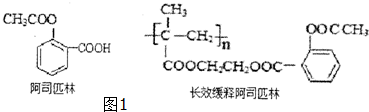
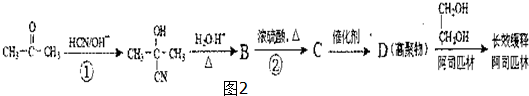
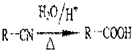 ,回答问题:
,回答问题: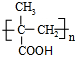 .
.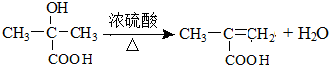 .
.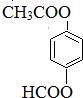 (只写一种).
(只写一种).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com