
【题目】分子式为C5H10的烯烃共有(要考虑顺反异构体)( )
A.5种 B.6种 C.7种 D.8种
科目:高中化学 来源: 题型:
【题目】“保护环境”是我国的基本国策.下列做法不应该提倡的是( )
A.使用氢能源代替化石燃料,减少CO2排放
B.就地在田间焚烧秸秆,减少运输成本
C.改进汽车尾气净化技术,减少污染物的排放
D.研发可降解高分子材料,减少“白色污染”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g)![]() cC(g)表示]化学平衡的影响,得到如图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率):
cC(g)表示]化学平衡的影响,得到如图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率):

分析图象,回答下列问题:
(1)在图象反应Ⅰ中,此正反应为________(填“吸热”或“放热”)反应,若p1>p2,则此反应的△S________0(填“>”或“<”),由此判断,此逆反应自发进行,必须满足的条件是____________.
(2)在图象反应Ⅱ中,T1_____T2(填“>”“<”或“=”),该正反应为_______(填“吸热”或“放热”)反应.
(3)在图象反应Ⅲ中,若T1<T2,则该反应_______(填“能”或“不能”)自发进行.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016年天津卷(节选)】
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
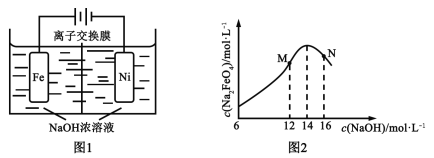
①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g)![]() CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
(1)反应的平衡常数表达式K=_____________;根据下图,升高温度,K值将__________(填“增大”、“减小”或“不变”)。
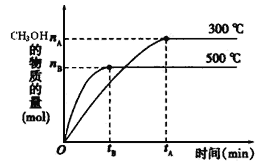
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是____________ (填字母)。
a.v生成(CH3OH)= v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是(填字母)___________________。
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡时c(H2)/ c(CH3OH)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺污染牛奶事件社会影响极坏。向牛奶和奶粉中添加三聚氰胺,主要是因为它能冒充蛋白质。已知三聚氰胺中含有碳、氢、氧三种元素,其相对分子质量为126。为测定三聚氰胺的组成,用下列各仪器装置,在过量的氧气流中将2.52g三聚氰胺样品氧化成CO2、H2O和N2。回答下列问题:
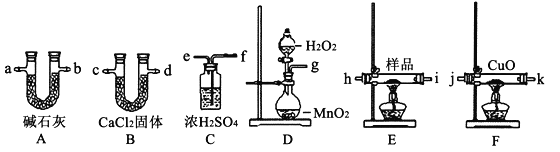
(1)产生的氧气按从左向右的流向,所选装置各导管的连接顺序是_________
g接、____接___、____接j、k接___、____接___。
(2)装置F中 CuO的作用是____________。
(3)实验前后称得A、B两装置的质量分别增加2.64g和1.08g,则三聚氰胺的分子式为______,又知三聚氰胺分子中有3个氨基(-NH2),且有类似苯环的对称结构,试写出三聚氰胺的结构简式________。
(4)按(1)的连接方法,此实验装置存在的缺点是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。
(1)某兴趣小组为研究原电池原理,设计如图A装置。
|
|
A | B |
①a和b不连接时,烧杯中发生反应的离子方程式是 ________________________。
②a和b用导线连接,Cu极为原电池________极(填“正”或“负”),该电极反应式是____________________。
③无论a和b是否连接,Zn片均被腐蚀,若转移了1mol电子, 则理论上Zn片质量减轻________g。
(2)如图是氢氧燃料电池原理示意图B,回答下列问题:电池的正极是________(填“a”或“b”)电极,该极的电极反应式为: _________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com