
| A. | KI的酸性溶液长期置于空气中:4I-+4H++O2═2I2+2H2O | |
| B. | 高锰酸钾酸性溶液与草酸溶液反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| C. | 用稀硫酸除去铁片表面的铁锈:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 硫代硫酸钠溶液中滴加稀硫酸:2H++S2O32-═S↓+SO2↑+H2O |
分析 A.碘化钾被氧气氧化生成单质碘;
B.草酸为弱酸,应保留化学式;
C.氧化铁与硫酸反应生成硫酸铁和水;
D.硫代硫酸钠溶液中滴加稀硫酸反应生成硫、二氧化硫和水.
解答 解:A.KI的酸性溶液长期置于空气中,离子方程式:4I-+4H++O2═2I2+2H2O,故A正确;
B.高锰酸钾酸性溶液与草酸溶液反应,离子方程式:6H++2MnO4-+5H2C2O4=10CO2↑+2Mn2++8H2O,故B错误;
C.用稀硫酸除去铁片表面的铁锈,离子方程式:Fe2O3+6H+═2Fe3++3H2O,故C正确;
D.硫代硫酸钠溶液中滴加稀硫酸,离子方程式:2H++S2O32-═S↓+SO2↑+H2O,故D正确;
故选:B.
点评 本题离子方程式的书写,明确发生的反应是解答本题的关键,注意化学式的拆分、注意氧化还原反应得失电子守恒.


科目:高中化学 来源: 题型:解答题
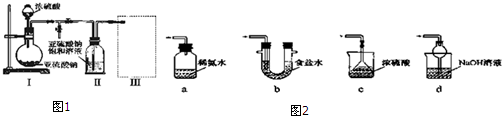
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | AgCl | AgI | Ag2S |
| 颜色 | 白 | 黄 | 黑 |
| Ksp(25℃) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
| A. | 溶度积小的沉淀可以转化为溶度积更小的沉淀 | |
| B. | 若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生 | |
| C. | 25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同 | |
| D. | 25℃时,AgCl固体在等质的量浓度的NaCl、CaCl2溶液中的溶度积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
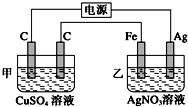 用如图所示的装置进行电解,在通电一段时间后,铁电极的质量增加.
用如图所示的装置进行电解,在通电一段时间后,铁电极的质量增加.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N≡N | N-H |
| 键能(kJ/mol) | 436 | 946 | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2a2=a1=197 | B. | 197>a1=2a2 | C. | a2>a1>197 | D. | 2a2<a1<197 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7 | B. | c(A-)>c(B+) | ||
| C. | c(OH-)=$\sqrt{{K}_{w}}$ | D. | c(H+)-c(OH-)=c(A-)-c(B+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol C3H8(g)与5 mol O2(g)反应生成3 molCO2(g)和4 mol H2O(g)放出热量大于2220.0 kJ | |
| B. | 1 mol C3H6与4.5 mol O2反应生成3molCO2和3 mol H2O放出热量等于2049.0 kJ | |
| C. | 丙烷分子储存的能量大于丙烯分子 | |
| D. | 丙烷转化为丙烯的过程是一个吸热过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com