
| 化学式 | 电离常数 |
| CH3COOH | Ka=1.76×10-5 |
| H2SO3 | Ka1=1.54×10-2 |
| Ka2=1.02×10-7 | |
| HF | Ka=6.03×10-4 |
| A. | 在1mol•L-1NaHA(酸式盐)溶液中一定存在:c(Na+)=c(H2A)+c(HA-)+c(A2-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 已知某温度下常见弱酸的电离平衡常数如上表:相同物质的量浓度的CH3COONa、NaF、Na2SO3、NaHSO3水溶液,溶液中离子总数由小到大排列的顺序是Na2SO3<CH3COONa<NaF<NaHSO3 | |
| D. | pH均等于3的醋酸与盐酸溶液等体积混合后,溶液的pH基本不变 |
分析 A.若H2A为二元强酸,在溶液中不存在H2A分子;
B.根据电荷守恒分析;
C.相同物质的量浓度的CH3COONa、NaF、NaHSO3水溶液,根据电离出的离子数目以及离子的水解程度判断离子总数关系,Na2SO3电离出两个阳离子和一个阴离子,离子数目最多;
D.由于盐酸和醋酸溶液的pH相等,两溶液中氢离子浓度相等,故将两溶液混合后氢离子浓度不变.
解答 解:A.若H2A为二元强酸,NaHA为强酸的酸式盐,溶液中可能不存在H2A,故A错误;
B.根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),溶液为酸性,故氢离子浓度大于氢氧根离子浓度,故c(Na+)<c(CH3COO-),故B错误;
C.相同温度下,酸的强弱酸性是:H2SO3>HF>CH3COOH,酸根离子水解程度大小顺序是:HSO3-<F-<CH3COO-,相同浓度的钠盐溶液中,酸根离子水解程度越大其溶液的离子总数相应变大,所以相同物质的量浓度的CH3COONa、NaF、NaHSO3水溶液,溶液中离子总数由小到大排列的顺序是NaHSO3<NaF<CH3COONa,而Na2SO3电离出两个阳离子和一个阴离子,离子数目最多,所以溶液中离子总数由小到大排列的顺序是NaHSO3<NaF<CH3COONa<Na2SO3,故C错误;
D.常温下,pH均等于3的醋酸与盐酸溶液等体积混合,由于两溶液中氢离子浓度相等,则混合液中氢离子浓度不变,所以混合液的pH仍然为3,故D正确.
故选D.
点评 本题考查了电解质溶液中离子浓度大小比较方法,溶液中电荷守恒的分析判断,溶液中离子的特征性质和水解、电离,是解题关键,题目难度中等,侧重于考查学生的分析应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入KSCN溶液(或硫氰化钾溶液) | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 固体中含有FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
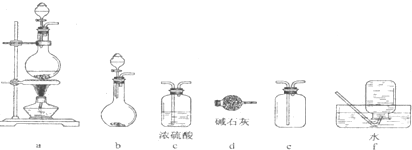
| A. | 加热浓硫酸和乙醇的混合物至170℃制备收集C2H4:连接a→d→f | |
| B. | 制备收集NO2:连接a→c→f | |
| C. | 制备收集Cl2:连接a→d→e | |
| D. | 制备收集NH3:连接b→d→e |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
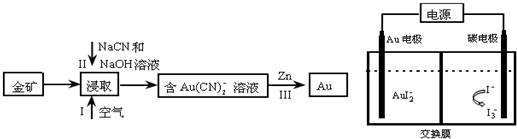
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
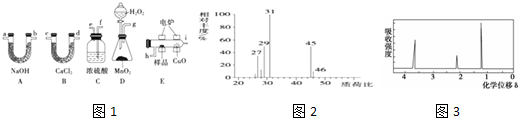
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
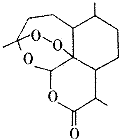 2015年10月5日,中国科学家屠哟坳首次获诺贝尔生理学或医学奖,以表彰她创制新型抗疟药-青蒿素和双氢青蒿素,其中青蒿素的结构简式如图所示,则青蒿素分子中碳、氧原子的个数比为( )
2015年10月5日,中国科学家屠哟坳首次获诺贝尔生理学或医学奖,以表彰她创制新型抗疟药-青蒿素和双氢青蒿素,其中青蒿素的结构简式如图所示,则青蒿素分子中碳、氧原子的个数比为( )| A. | 2:1 | B. | 3:1 | C. | 12:5 | D. | 16:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com