
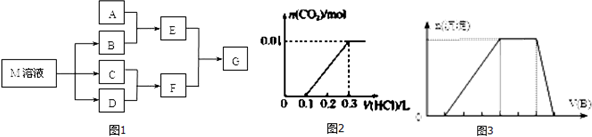
 .
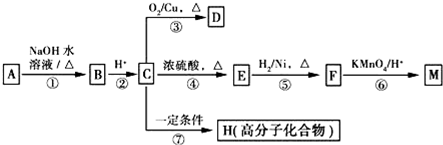
.分析 (1)C可在D中燃烧发出苍白色火焰,为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,由转化关系可知,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH,
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,与F溶液反应可以制备G为H2SiO3;
(3)若A是CO2气体,CO2与NaOH溶液能够反应生成碳酸钠或碳酸氢钠或两者的混合物,也有可能氢氧化钠过量,反应后所得的溶液再与盐酸反应,溶液中溶质只有碳酸钠,则碳酸钠转化为碳酸氢钠消耗盐酸体积与碳酸氢钠反应生成二氧化碳消耗盐酸体积相等,而图2中前后消耗盐酸体积之比为1:2,则CO2与NaOH溶液反应生成碳酸钠、碳酸氢钠;
(4)若A是一种常见金属单质,且与NaOH溶液能够反应,则A为Al,E为NaAlO2,则将过量的HCl溶液逐滴加入NaAlO2溶液中,先生成氢氧化铝,而后氢氧化铝溶解;
(5)若A是一种化肥,实验室可用A和NaOH反应制取气体E,E与F相遇均冒白烟,则E为NH3、A为铵盐,E与氯气相遇均冒白烟,且利用E与氯气的反应检验输送氯气的管道是否泄露,则氨气与氯气反应生成氯化铵,同时生成氮气;
(6)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,根据各阶段消耗的NaOH体积结合离子方程式计算n(H+):n(Al3+):n(NH4+)之比,再结合电荷守恒计算与n(SO42-)的比例关系,据此计算.
解答 解:(1)C可在D中燃烧发出苍白色火焰,为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,由转化关系可知,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH,HCl的电子式为: ,故答案为:
,故答案为: ;
;
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,与F溶液反应可以制备G为H2SiO3,E的溶液俗称水玻璃,
故答案为:水玻璃;
(3)若A是CO2气体,CO2与NaOH溶液能够反应生成碳酸钠或碳酸氢钠或两者的混合物,也有可能氢氧化钠过量,反应后所得的溶液再与盐酸反应,溶液中溶质只有碳酸钠,则碳酸钠转化为碳酸氢钠消耗盐酸体积与碳酸氢钠反应生成二氧化碳消耗盐酸体积相等,而图2中前后消耗盐酸体积之比为1:2,则CO2与NaOH溶液反应后溶液中溶质为Na2CO3和NaHCO3,
故答案为:Na2CO3和NaHCO3;
(4)若A是一种常见金属单质,且与NaOH溶液能够反应,则A为Al,E为NaAlO2,则将过量的HCl溶液逐滴加入NaAlO2溶液中,先生成氢氧化铝,而后氢氧化铝溶解,故看到的现象为:溶液中逐渐有白色絮状沉淀生成,且不断地增加,随后沉淀逐渐溶解最终消失,
故答案为:溶液中逐渐有白色絮状沉淀生成,且不断地增加,随后沉淀逐渐溶解最终消失;
(5)若A是一种化肥,实验室可用A和NaOH反应制取气体E,E与F相遇均冒白烟,则E为NH3、A为铵盐,E与氯气相遇均冒白烟,且利用E与氯气的反应检验输送氯气的管道是否泄露,则氨气与氯气反应生成氯化铵,同时生成氮气,反应方程式为:3Cl2+8NH3=N2+6NH4Cl,
故答案为:3Cl2+8NH3=N2+6NH4Cl;
(6)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,
发生反应H++OH-=H2O,氢离子消耗NaOH溶液的体积为1积,
发生反应Al3++3OH-=Al(OH)3↓,铝离子消耗NaOH溶液的体积为3体积,
发生反应NH4++OH-=NH3•H2O,铵根消耗氢氧化钠为2体积,
则n(H+):n(Al3+):n(NH4+)=1:1:2,由电荷守恒可知,n(H+):n(Al3+):n(NH4+):n(SO42-)=1:1:2:3,故c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3,
故答案为:c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3.
点评 本题考查无机物推断等,题目涉及元素化合物较多,需要学生全面掌握据基础知识,(6)中根据图象中的平台确定含有铵根离子是关键,注意离子方程式与电荷守恒的应用,难度中等.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:推断题

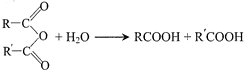
 ,G
,G

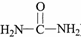 )氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式
)氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式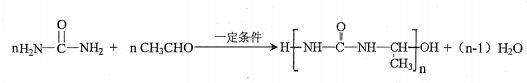
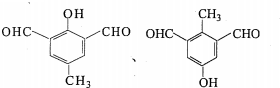 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
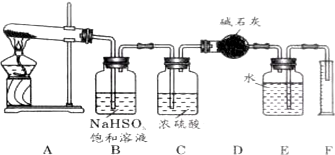
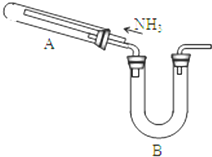 某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如图.
某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如图.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
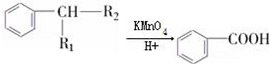 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)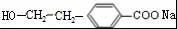 .
.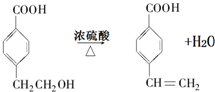 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向煤中加入适量CaO,可大大减少燃烧产物中SO2的量 | |
| B. | 葡萄酒中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业采用火法炼铜:Cu2S+O2=2Cu+SO2 每生成2mol铜,反应共转移4NA个电子 | |
| B. | 7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.1NA | |
| C. | CO2通过Na2O2使其增重bg时,反应中转移的电子数为$\frac{b{N}_{A}}{44}$ | |
| D. | 0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数目为0.02NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com