


科目:高中化学 来源: 题型:
| 400℃~500℃ |
| 500℃~600℃ |
| 700℃~800℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
查看答案和解析>>
科目:高中化学 来源: 题型:
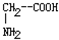 和丙氨酸
和丙氨酸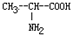 混合反应,生成的“二肽”最多为
混合反应,生成的“二肽”最多为查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (×10-3mol?L-1?min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | ||
| B、电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | ||
C、CH3COOH 溶液加水稀释后,溶液中
| ||
| D、浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com