
黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O→SO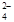 + 2Fe2+ + 4H+
+ 2Fe2+ + 4H+
Cr2O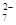 + 6 Fe2+ + 14 H+ →2 Cr3+ + 6 Fe3+ + 7 H2O
+ 6 Fe2+ + 14 H+ →2 Cr3+ + 6 Fe3+ + 7 H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应) 。
(2)若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为 ,制得98%的硫酸质量为 t ,SO2全部转化为H2SO4时放出的热量是 kJ。
(1)90.00%
(2)SO3(g)+H2O(1)═H2SO4(1);△H═-130.3 kJ/mol
(3).36×106;15;3.43×107
解析试题分析:
(1)取0.1000g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。假设硫化亚铁物质的量为x,则3FeS2~6SO2~12Fe2+~2Cr2O72-
3 2
x 0.02000mol/l×0.02500L x=0.00075mol
所以样品中FeS2的质量分数=0.00075×120/0.1000×100%=90.00%
(2)灼烧6g FeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,依据硫元素守恒n(S)=2n(FeS2)=6g/120g.mol-1×2=0.1mol。产生的0.1molSO3与水全部化合生成H2SO4,放出13.03kJ热量,1molSO3与水全部化合生成H2SO4,放出130.3kJ,SO3气体转化为H2SO4的热化学方程式为:SO3(g)+H2O(1)═H2SO4(1);△H═-130.3 kJ/mol;故答案为:SO3(g)+H2O(1)═H2SO4(1);△H═-130.3 kJ/mol
(3)煅烧10t上述黄铁矿,含有FeS2的质量=10×106×90%=9×106g,物质的量=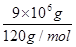 =7.5×104mol,依据硫元素守恒,理论上产生SO2的体积=7.5×104mol×2×22.4L/mol=3.36×106 L;理论上得到硫酸物质的量为7.5×104mol×2=1.5×105mol,质量=1.5×105mol×98g/mol=1.47×107g,制得98%的硫酸质量=
=7.5×104mol,依据硫元素守恒,理论上产生SO2的体积=7.5×104mol×2×22.4L/mol=3.36×106 L;理论上得到硫酸物质的量为7.5×104mol×2=1.5×105mol,质量=1.5×105mol×98g/mol=1.47×107g,制得98%的硫酸质量=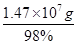 =1.5×107g=15t。依据上题可知,0.1mol二氧化硫全部反应生成三氧化硫放热9.83kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03kJ热量,1.5×105molSO2全部转化为H2SO4时放出的热量=1.5×105mol×98.3KJ/mol+1.5×105mol×130.3KJ/mol=3.429×107KJ。故答案为:3.36×106;15;3.43×107。
=1.5×107g=15t。依据上题可知,0.1mol二氧化硫全部反应生成三氧化硫放热9.83kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03kJ热量,1.5×105molSO2全部转化为H2SO4时放出的热量=1.5×105mol×98.3KJ/mol+1.5×105mol×130.3KJ/mol=3.429×107KJ。故答案为:3.36×106;15;3.43×107。
考点:化学计算


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
把2.0mol/LCuSO4溶液和1.0mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于两溶液的体积之和)。
(1)溶液中H+的物质的量浓度为 ,SO42-的物质的量浓度为 。
(2)向混合溶液中加入足量的铁粉,经足够长的时间后,铁粉有剩余。此时,溶液中的Fe2+物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某学生欲配制6.0 mol·L-1的H2SO4 1 000 mL,实验室有三种不同浓度的硫酸:①480 mL 0.5 mol·L-1的硫酸;②150 mL 25%的硫酸(ρ=1.18 g·mL-1);③足量的18 mol·L-1的硫酸。有三种规格的容量瓶:250 mL、500 mL、1 000 mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为________mol·L-1(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为________mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的 18 mol·L-1的浓硫酸 mL,沿玻璃棒倒入上述混合液中。
并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D.______________________________________;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2 cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?________(填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定量的氢气在氯气中燃烧,所得混合物用100ml 3.00mol/L的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 mol。
(1)所得溶液中Cl-的物质的量为 mol。
(2)参加反应的氢气在标准状况下的体积是 L。(写出计算过程,下同)
(3)所用氯气和参加反应的氢气的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在300 mL2mol/LH2SO4溶液中,溶质的质量是 ,此溶液中含H+的物质的量是 ,H+的物质的量浓度是 ,其中含有 个SO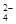 ,SO
,SO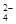 的物质的量浓度是 。
的物质的量浓度是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)①现有11g由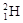 和
和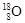 组成的水分子的物质的量 mol,其中含中子数为 mol,电子数为 个。
组成的水分子的物质的量 mol,其中含中子数为 mol,电子数为 个。
②请画出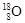 2-微粒的结构示意图: 。
2-微粒的结构示意图: 。
(2)质量相等的两种物质SO2和SO3,两种物质中硫元素质量之比为 ,分子物质的量之比为 ,所含氧原子个数之比为 。
(3)0.2L 0.5mol/L Al2(SO4)3溶液和0.5L 0.5mol/L Al2(SO4)3溶液所含SO42—离子浓度之比为____________,SO42—离子数目之比为____________。
(4)20.6g NaR 含有Na+0.2mol,则NaR的摩尔质量为 ,则含R 8.0g 的NaR的物质的量为 mol 。
(5)实验室用二氧化锰与浓盐酸反应制取氯气,反应方程式如下:
MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑。若0.1 molMnO4与足量的浓盐酸充分反应,则有 mol HCl被氧化,转移电子的物质的量为 mol,产生的Cl 2在标准状况下的体积为 L。
MnCl2+2H2O+Cl2↑。若0.1 molMnO4与足量的浓盐酸充分反应,则有 mol HCl被氧化,转移电子的物质的量为 mol,产生的Cl 2在标准状况下的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某研究小组以CaCl2和H2为原料,试图制备 +1价Ca的化合物,结果发现产物中只有两种化合物(甲和乙)。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%;化合物乙的水溶液显酸性。请回答下列问题:
(1)该研究小组是否成功制得 +1价Ca的化合物? (填“是”或“否”)。甲的化学式是 。
(2)甲与水反应可得H2,其化学方程式是 。反应所得溶液经结晶后,可得到一种晶体,其化学式为CaCl2· xCa(OH)2· 12H2O。为确定x的值,请设计实验方案 。
(3)在加热条件下,乙的水溶液(浓)与MnO2反应的离子方程式是 ;乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是 。
(4)请写出一个你认为可能得到CaCl的化学方程式(以CaCl2为原料) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。
(1)现有一种无色的鲜花营养液,可能由硝酸钙、碳酸钾、硝酸钾、氯化钾中的一种或几种物质组成,为探究其成分,某同学设计并完成了如下图所示的实验。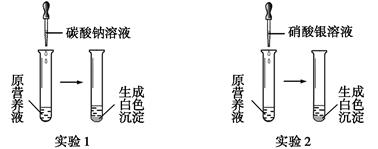
根据以上实验,请你填空。
①由实验1可确定原营养液中一定没有的物质是 (填化学式),写出生成白色沉淀的离子方程式是 。
②若测得原营养液中K+、Cl-的数目之比为2∶1,则原营养液是由 种溶质配制成的。
③某同学用氯化钙、硝酸钾、氯化钾配成的营养液中K+、Cl-、NO3-的数目之比为2∶5∶1,
则所用硝酸钾和氯化钙的物质的量之比是 。
(2)下表是500mL某“鲜花保鲜剂”中含有的成分,阅读后回答下列问题。
| 成分 | 质量(g) | 摩尔质量(g ·mol-1) |
| 蔗糖 | 68.4 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将0.1 mol的镁和铝的混合物溶于50 mL 4 mol·L-1 H2SO4溶液中,然后再滴加2 mol·L-1的NaOH溶液。请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示。当V1=80 mL时,计算金属粉末中镁的物质的量及V2的体积。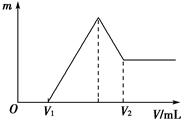
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,计算滴入NaOH溶液的体积。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com