
【题目】下列有关热化学方程式的叙述正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(g);△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ
B. 已知4P(红磷,s)=P4(白磷,s);△H>0,则白磷比红磷稳定
C. 含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+ ![]() H2SO4(aq)=
H2SO4(aq)= ![]() Na2SO4(aq)+H2O(l);△H=﹣57.4kJ/mol
Na2SO4(aq)+H2O(l);△H=﹣57.4kJ/mol
D. 己知C(s)+O2(g)=CO2(g);△H1 C(s)+ ![]() O2(g)=CO(g);△H2 则△H1>△H2
O2(g)=CO(g);△H2 则△H1>△H2
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.石油裂化主要得到乙烯
B.热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= -802.3kJ/mol中△H, 可以表示甲烷的燃烧热
C.蛋白质、纤维素、淀粉都是高分子化合物
D.煤的气化是物理变化,是高效、清洁地利用煤的重要途径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol·L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )

A. M点溶液中水的电离程度比原溶液大
B. a=0.05
C. 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O],又称轻质碳酸镁。常利用菱镁矿(质量含量为碳酸镁90%,碳酸钙10%)碳化法制取:

(1)根据下列表格数据,选择消化反应的最佳温度__________;理由是___________________________。
消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为____________。
(3)流程图中__________和__________可以为碳化反应提供二氧化碳源。
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5mol·L-1时,可以认为完全除去。常温时当调节溶液PH为9.5时,此时Mn2+小于__________mol·L-1,不会沉淀出来。
物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为__________。
A.Ca(ClO)2 B.Cl2 C.H2O2 D.HNO3
③下列方案中,较好的为__________,理由是______________________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有pH为1的100mL 0.1moL/L 的AlCl3溶液,下列有关判断正确的是:
A.溶液显酸性,主要因为铝离子水解导致的
B.溶液显酸性,主要因为溶液中有盐酸
C.溶液显碱性,主要因为铝离子水解导致的
D.溶液显碱性,主要因为铝离子水解导致的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组混合物中,不论二者以什么比例混合,只要总质量一定,完全燃烧时生成CO2的质量也一定,下列各组不正确的是
A. 甲烷、辛醛 B. 乙炔、苯乙烯
C. 甲醛、甲酸甲酯 D. 苯、甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为C、H、0、N、P等元素构成化合物甲、乙、丁及结构丙的示意图,下列说法错误的是
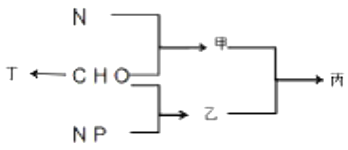
A. 若基因在结构丙上呈线性排列,则甲的单体用双缩脲试剂检测呈紫色
B. 若丁是真核细胞中良好的储能物质,则其合成场所为一种具膜的细胞器
C. 若丙是原核细胞内蛋白质合成场所,则乙彻底水解产物有6种
D. 若丙是一种生物膜,则其功能与膜上甲的种类和数量有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国正在推广使用乙醇汽油。所谓乙醇汽油就是在汽油中加入适量乙醇(一般为10:l)混合而成的一种燃料。下列有关叙述错误的是
A. 由石油可以制得汽油
B. 乙醇汽油是一种新型的化合物
C. 汽车使用乙醇汽油可以减少有害气体的排放
D. 由玉米、高梁发酵可以制得乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E五种短周期元素,已知相邻的A,B,C,D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同.
回答下列问题: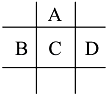
(1)A与E形成的化合物的化学式是 .
(2)B的最高价氧化物化学式为 , C的元素名称为 , D的单质与水反应的方程式为
.
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是 , 有关反应的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com