
【题目】下列说法正确的是
A.![]()
![]() ,结论:
,结论:![]() 的燃烧热为
的燃烧热为![]()
B.稀溶液中有![]()
![]() ,结论:将盐酸与氨水的稀溶液混合后,若生成
,结论:将盐酸与氨水的稀溶液混合后,若生成![]() ,则会放出
,则会放出![]() 的能量
的能量
C.相同条件下,如果![]() 氢原子所具有的能量为
氢原子所具有的能量为![]() ,
,![]() 氢分子所具有的能量为
氢分子所具有的能量为![]() ,则
,则![]()
D.![]() 气态乙硼烷
气态乙硼烷![]() 在
在![]() 中完全燃烧生成固态
中完全燃烧生成固态![]() 和液态水,同时放出
和液态水,同时放出![]() 的热量,该反应的热化学方程式为
的热量,该反应的热化学方程式为![]()
![]()
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论均正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 取少量Na2SO3固体于试管中,加水溶解,滴加Ba(NO3)2溶液,再滴加稀硝酸 | 滴加Ba(NO3)2溶液,产生白色沉淀,再滴加稀硝酸,沉淀不溶解 | Na2SO3固体已经变质 |
B | 将SO2通入酸性KMnO4溶液中 | 溶液的紫红色褪去 | SO2具有漂白性 |
C | 将铁片投入浓硫酸中 | 无明显变化 | 常温下铁不与浓硫酸反应 |
D | 将10mL2mol/L的KI溶液与1mL1mol/LFeCl3溶液混合充分反应后滴加KSCN溶液 | 溶液颜色变红 | KI与FeCl3的反应具有可逆性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.中和热测定实验中需要的玻璃仪器有:烧杯、量筒、温度计、环形玻璃搅拌棒
B.乙烯的燃烧热为1411.3 kJ·mol1,则乙烯燃烧的热化学方程式为C2H4(g)+3O2(g)![]() 2CO2(g)+2H2O(g) ΔH= 1411.3 kJ·mol1
2CO2(g)+2H2O(g) ΔH= 1411.3 kJ·mol1
C.用石墨电极电解1 L 0.1 mol·L1 CuSO4溶液,若反应产生0.1 mol O2,则向原溶液中加入0.2 mol CuO能恢复至原浓度
D.用pH试纸分别测定氯水和盐酸的pH,比较两溶液的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值)
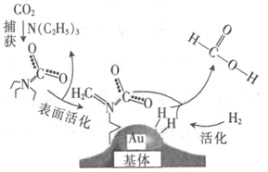
A.标准状况下,22.4 L CO2中所含的电子数目为16NA
B.10.1 g N(C2H5)3中所含的极性共价键数目为2.1NA
C.2 mol Au与2 mol H2中所含的分子数目均为2NA
D.100 g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在科学家正在寻求将太阳能转化成化学能的方法,其中之一就是利用太阳能将![]() 分解成
分解成![]() ,再将化学能转化为其他能源。下面是有关的能量循环示意图,下列有关说法正确的是
,再将化学能转化为其他能源。下面是有关的能量循环示意图,下列有关说法正确的是

A.图中![]()
B.如果![]() 的键能为
的键能为![]() ,
,![]() 键能为
键能为![]() ,则断开
,则断开![]() 水蒸气中
水蒸气中![]() 键所需要的太阳能为
键所需要的太阳能为![]()
C.![]() 燃烧热为
燃烧热为![]()
D.水蒸气所具有的能量比液态水多![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙胺(CH3-CH2-NH2)极易挥发,溶于水、乙醇、乙醚等,可用于生产染料、医药和离子交换树脂等。将乙醇与氨气置于温度为350~400℃、压强为2.45~2.94MPa和催化剂为氧化铝的条件下反应可制备乙胺。
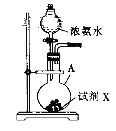
Ⅰ.氨气的制备
(1)用如图所示装置制备NH3。
①仪器A的名称是___。
②试剂X可能是CaO或__(填试剂名称),若选择CaO时,能产生NH3的原因是___。
Ⅱ.乙胺的制备与提纯
(2)乙胺的制备:
生成乙胺(CH3CH2-NH2)的化学方程式为___。(可不写反应条件)
(3)已知:制备过程中除了生成乙胺外,还会产生二乙胺、三乙胺、乙醚、乙氰和乙烯。
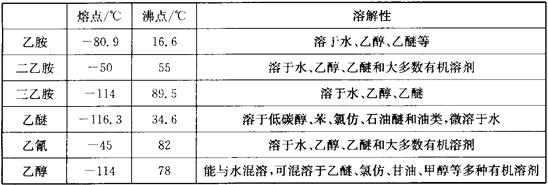
用如图装置提纯乙胺:
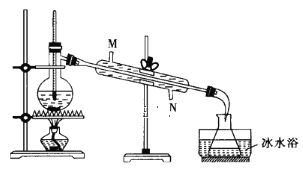
①提纯乙胺装置中的一处错误是___。
②冷凝管的冷水(10℃)由___(填“M”或“N”)口流出。
③错误纠正后蒸馏,收集___℃左右的馏分。
④冰水浴的作用是___。
(4)乙醇的密度为0.8g·cm-3,若取230.00mL无水乙醇,与过量氨气反应后,经提纯后得到142.02g乙胺,则乙胺的产率为__%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于平衡状态的反应2H2S(g)![]() 2H2(g)+S2(g) ΔH>0,合理的说法是( )
2H2(g)+S2(g) ΔH>0,合理的说法是( )
A. 加入催化剂,反应途径将发生改变,ΔH也将随之改变
B. 升高温度,正逆反应速率都增大,H2S分解率也增大
C. 增大压强,平衡向逆反应方向移动,将引起体系温度降低
D. 若体系恒容,注入一些H2后达新平衡,H2浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池,如图所示。

请回答下列问题:
(1)电极X的材料是___;电解质溶液Y是___。
(2)银电极为电池的___极,发生的电极反应为___。X电极上发生的电极反应为___。
(3)外电路中的电子是从____极流向___极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某恒温恒容的密闭容器内发生反应:2A(g)+B(g)![]() C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
A. 再充入2mol A,平衡正移,A的转化率增大
B. 如果升高温度,C的体积分数增大
C. 如果增大压强,化学平衡一定向正反应方向移动,B的体积分数减小
D. 再充入1mol C,C的物质的量浓度将增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com