
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)在鼓泡反应器中通入含有SO2和NOx的烟气,反应温度为323K,NaClO2碱性溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/mol·L1 | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2碱性溶液脱硝(NO)过程中主要反应的离子方程式:____。增加压强,NO的转化率___(填“提高”“不变”或“降低”)
②由实验结果可知,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。
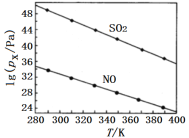
由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均___(填“增大”“不变”或“减小”)。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是___。
【答案】2OH-+3ClO2-+4NO=4NO3-+3Cl-+2H2O 提高 NO溶解度较低或脱硝反应活化能较高或SO2的溶解度大于NO或二氧化硫的还原性强,易被氧化 减小 由于生成的硫酸钙微溶,降低硫酸根离子浓度,促使平衡向正反应方向进行,所以Ca(ClO)2效果好
【解析】
(1)①亚氯酸钠具有氧化性,分析题给数据知NaClO2溶液脱硝过程中主要生产硝酸根和氯离子,利用化合价升降法结合原子守恒和电荷守恒配平,该反应的离子方程式为2OH-+3ClO2-+4NO=4NO3-+3Cl-+2H2O;该反应正反应是气体体积减小的,则增加压强,平衡正向移动,NO的转化率提高;
②由实验结果可知,在相同时间内硫酸根离子的浓度增加的多,因此脱硫反应速率大于脱硝反应速率。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高或SO2的溶解度大于NO或二氧化硫的还原性强,易被氧化;
(2)由图分析可知,反应温度升高,O2和NO的平衡分压负对数减小,这说明反应向逆反应方向进行,因此脱硫、脱硝反应的平衡常数均减小;
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。由于生成的硫酸钙微溶,降低硫酸根离子浓度,促使平衡向正反应方向进行,所以Ca(ClO)2效果好。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】按要求书写下列反应的方程式:
(1)NO2溶于水的化学反应方程式:__。
(2)实验室制取氨气的化学反应:__。
(3)乙醇与乙酸的酯化反应方程式:__。
(4)红热的碳和浓硝酸的化学反应方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是氯化钠晶体和二氧化碳晶体的结构示意图,关于两种晶体说法正确的是
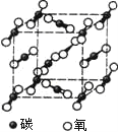
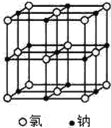
A.两种晶体内均含有共价键B.构成两种晶体的微粒均是原子
C.两种晶体均属于离子晶体D.两者的硬度、熔沸点差别较大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z,它们在周期表中位置如图所示,X的一种氢化物与其最高价氧化物对应水化物反应生成盐。下列说法正确的是
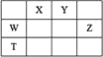
A.T元素单质具有半导体的特性,T与Y元素可形成两种化合物TY和![]()
B.由Y、Z和氢三种元素形成的化合物中,Z的化合价越高氧化性越强
C.W的氧化物是酸性氧化物,能与碱、水反应,不能与酸反应
D.X的氢化物分子中所有原子均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温条件下浓度均为0.1 molL-1的甲、乙、丙、丁四种溶液,甲为NaOH溶液,乙为HCl溶液,丙为CH3COOH溶液,丁为氨水,已知Ka(CH3COOH)=Kb(NH3H2O)试回答下列问题:
(1)甲、丁种溶液中由水电离出的c(OH)的大小关系为甲___丁(填“大于”“小于”或“等于”)。
(2)将一定体积的甲与乙混合,所得溶液pH=12,则二者的体积比为v甲∶v乙=___。
(3)某同学用甲滴定丙溶液、乙滴定丁溶液,得到如图所示两条滴定曲线,请完成有关问题:
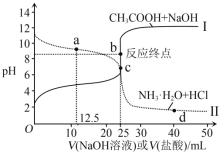
①乙溶液滴定丁溶液最适合的指示剂是___;甲溶液滴定丙溶液,选用酚酞为指示剂,则达到滴定终点的标志是___。
②计算滴定至b点时,c(CH3COOH)+c(CH3COO-)=___molL-1
③向氨水中滴加盐酸至a点,溶液中离子浓度从大到小的顺序为___,若加盐酸vmL时,溶液恰好呈中性,用含v的代数式表示出Kb=___(不考虑溶液混合体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl是应用广泛的有机合成催化剂,可从黄铜矿(主要成分为CuFeS2)中制取。
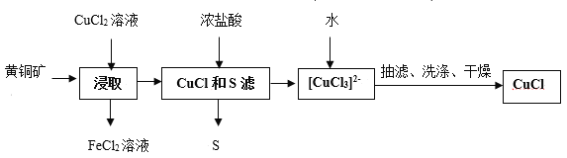
已知:CuCl是一种白色粉末,微溶于水,难溶于乙醇,在空气中易被氧化,在水溶液中存在平衡:CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq)(无色溶液)
[CuCl3]2-(aq)(无色溶液)
下列叙述错误的是( )
A.浸取中的主要反应为CuFeS2+3CuCl2=4CuCl+FeCl2+2S
B.浸取所得到的FeCl2溶液,可用来腐蚀覆在绝缘板上的铜箔制造印刷电路板
C.加水有利于CuCl(s)+2Cl(aq)-![]() [CuCl3]2-(aq)平衡逆向移动,析出CuCl
[CuCl3]2-(aq)平衡逆向移动,析出CuCl
D.为提高产率和纯度,可采用乙醇洗涤、真空干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为元素周期表中原子序数依次增大的短周期主族元素,X、Y、Z分别为B、C、E对应的单质,甲、乙 、丙、丁为其中部分元素组成的化合物,其中C、D同主族,甲是一种能使湿润的红色石蕊试纸变蓝的气体,甲可用于检验Z气体是否泄漏。上述物质间的转化关系如图所示:

(1)B、C、D、E四种元素形成的简单离子中,离子半径由小到大的顺序是___(用化学用语表示)。
(2)下列事实能说明D元素的非金属性小于E的是___
a.对应氢化物的还原性:D>E
b.D和E两元素的简单氢化物受热分解,后者的分解温度高
c.单质的沸点:D>E
(3)已知元素Ts位于第七周期,与E同族,写出其中子数为176的核素符号___,预测Ts及其化合物最不可能具有的性质是___。
a.单质易溶于某些有机溶剂 b.单质是有色固体
c.氢化物很稳定 d.简单阴离子可与Ag+形成难溶物
(4)A、B两种元素可组成一种离子化合物BA5,该化合物的电子式为___。
(5)A、B、D三种元素组成离子化合物W,已知:
①1molW能与足量氢氧化钠溶液共热,生成22.4L气体(标准状况);
②W能与盐酸反应产生一种臭鸡蛋气味的气体。则W是___,写出①的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间的转化关系如图所示。下列有关物质的推断正确的是( )
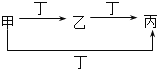
甲 | 乙 | 丙 | 丁 | |
A | S | SO2 | SO3 | O2 |
B | CO32- | HCO3- | CO2 | H+ |
C | Cl2 | FeCl3 | FeCl2 | Fe |
D | Al3+ | Al(OH)3 | AlO2- | NH3H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙酸和乙醇在浓硫酸作用下制取乙酸乙酯的装置如图。下列说法正确的是
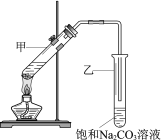
A. 向甲试管中先加浓硫酸,再加乙醇和乙酸
B. 乙试管中导管不伸入液面下,是为了防止倒吸
C. 加入过量乙酸,可使乙醇完全转化为乙酸乙酯
D. 实验完毕,可将乙酸乙酯从混合物中过滤出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com