
分析 在25℃时,用石墨电极电解CuSO4溶液,阳极反应为:4OH--4e-═2H2O+O2↑,阴极电极反应为Cu2++2e-=Cu,总反应离子方程式为2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑,当阳极产生标准状况下气体1.12L时,生成氧气的物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,电子转移0.05mol×4=0.2mol,同时阴极析出铜6.4g,据此分析计算.
解答 解:(1)在25℃时,用石墨电极电解CuSO4溶液,阳极反应为:4OH--4e-═2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu;当阳极产生标准状况下气体1.12L时,生成氧气的物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,电子转移0.05mol×4=0.2mol,同时阴极析出铜6.4g,电解过程中,阳极反应为4OH--4e-═2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu,总反应离子方程式为2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑,
2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑,
2mol 4mol 22.4L
n(Cu2+) n(H+) 1.12L
n=$\frac{4mol×1.12L}{22.4L/mol}$=0.2mol,
c(H+)=$\frac{0.2mol}{0.2L}$=1mol/L,pH=0,
答:所得溶液的pH为0;
(2)析出氧气的质量为0.05mol×32g/mol=1.6g,析出铜的质量为6.4g,故原溶液质量为1.6g+6.4g+1.2g•cm-3×200mL=248.0g,
答:电解前所取CuSO4溶液的质量为248.0g.
点评 本题考查了电解原理的应用,电极反应的书写方法,电子守恒的计算应用,中等难度,清楚电极反应是解题的关键.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题
 ,其NMR谱中有两个信号峰,强度之比为3:1.
,其NMR谱中有两个信号峰,强度之比为3:1.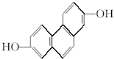 的有机物,在NMR谱上观察峰给出的强度之比为1:1:1:1:1;
的有机物,在NMR谱上观察峰给出的强度之比为1:1:1:1:1;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  表示稀释冰醋酸过程中溶液导电性的变化曲线 | |
| B. |  曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 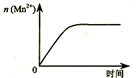 表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 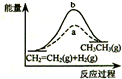 a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,4,4-三甲基戊烷 | B. | 4-甲基-2-戊烯 | ||
| C. | 4-甲基-5-乙基庚烷 | D. | 1,2,4-三甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO4-、Fe2+、K+、Cl- | B. | Ca2+、Na+、Cl-、SO42- | ||
| C. | Ca2+、Cl-、NO3-、K+ | D. | Ca2+、H+、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如下图所示.
将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如下图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 117号元素位于第七周期第ⅦB族 | B. | 117号元素是一种金属元素 | ||
| C. | 117号元素最外层有5个电子 | D. | 117号元素没有正化合价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若XY3分子中X原子处于正三角形的中心,则XY3分子为非极性分子 | |
| B. | C2H5OH与C2H5Br相比,前者的沸点远高于后者,其原因是前者的分子间存在氢键 | |
| C. | 同周期ⅠA族元素和ⅦA族元素之间只能形成离子化合物 | |
| D. | 由两种非金属元素组成的化合物分子中只可能有极性键,不会有非极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com