
【题目】2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法不正确的是( )

A.ΔH1=ΔH2+ΔH3+ΔH4+ΔH5+ΔH6+ΔH7
B.ΔH4的值数值上和Cl-Cl共价键的键能相等
C.ΔH7<0,且该过程形成了分子间作用力
D.ΔH5<0,在相同条件下,2Br(g)的ΔH5′>ΔH5
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,易溶于水,难溶于CCl4,某研究小组用如图1所示的实验装置制备氨基甲酸铵。
反应原理:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H<0。
NH2COONH4(s) △H<0。
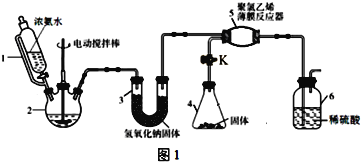
(1)仪器2的名称是__。仪器3中NaOH固体的作用是__。
(2)①打开阀门K,仪器4中由固体药品所产生的气体就立即进入仪器5,则该固体药品的名称为__。
②仪器6的一个作用是控制原料气按反应计量系数充分反应,若反应初期观察到装置内稀硫酸溶液中产生气泡,应该__(填“加快”、“减慢”或“不改变”)产生氨气的流速。
(3)另有一种制备氨基甲酸铵的反应器(CCl4充当惰性介质)如图2:
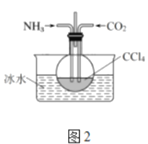
①图2装置采用冰水浴的原因为__。
②当CCl4液体中产生较多晶体悬浮物时,即停止反应,__(填操作名称)得到粗产品。
为了将所得粗产品干燥可采取的方法是__。
A.蒸馏 B.高压加热烘干 C.真空微热烘干
(4)①已知氨基甲酸铵可完全水解为碳酸氢铵,则该反应的化学方程式为__。
②为测定某样品中氨基甲酸铵的质量分数,某研究小组用该样品进行实验。已知杂质不参与反应,请补充完整测定某样品中氨基甲酸铵质量分数的实验方案:用天平称取一定质量的样品,加水溶解,__,测量的数据取平均值进行计算(限选试剂:蒸馏水、澄清石灰水、Ba(OH)2溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,工业上可用NO和Cl2合成。回答下列问题:
(1)已知:①2NO2(g)+NaCl(s)NaNO3(s)+NOCl(g) △H1
②4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) △H2
③2NO(g)+Cl2(g) 2NOCl(g) △H3
则△H3=_____________(用含△H1、△H2的代数式表示)。
(2)一定温度下,向2L密闭容器中充入amol NOCl(g),发生反应2NOCl(g)2NO(g)+Cl2(g)。
①已知上述反应中正反应速率的表达式为v正=k·cn(NOCl)。300℃时,测得正反应速率与NOCl的浓度的关系如表所示:
c(NOCl)/(mol/L) | v正/(molL-1s-1) |
0.20 | 1.6×10-9 |
0.40 | 6.4×10-9 |
0.60 | 1.44×10-8 |
n=______;k=_____L·mol-1·s-1;当c(NOCl)=0.50 mol·L-1时,v正=_____mol·L-1·s-1。
②测得NO的物质的量浓度与温度的关系如图所示(x<0.5a),T1________T2(填“>”“<”或“=”);T2温度下,该反应的平衡常数K=________mol·L-1(用含a、x的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂有苯酚和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中__加入甲醛,且反应釜应装有__装置;
(2)玻璃纤维由玻璃拉丝得到.普通玻璃是由石英砂、__和石灰石(或长石)高温熔融而成,主要反应的化学方程式为__;
(3)玻璃钢中玻璃纤维的作用是__;玻璃钢具有__等优异性能(写出亮点即可);
(4)下列处理废旧热固性酚醛塑料的做法合理的是__;
a.深埋 b.粉碎后用作树脂填料
c.用作燃料 d.用有机溶剂将其溶解,回收树脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑索金是一种爆炸力极强的烈性炸药,比TNT猛烈1.5倍。可用浓硝酸硝解乌洛托品得到黑索金,同时生成硝酸铵和甲醛(HCHO)。下列说法不正确的是( )
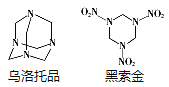
A.乌洛托品的分子式为C6H12N4
B.乌洛托品分子结构中含有3个六元环
C.乌洛托品的一氯代物只有一种
D.乌洛托品得到黑索金反应中乌洛托品与硝酸的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各组离子一定能大量共存的是
A.使石蕊试液呈红色的溶液中:Na+、Al3+、NO3-、![]()
B.![]() =0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3-
=0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3-
C.含有0.1 mol·L-1 HCO3-的溶液:Na+、Fe3+、NO3-、SCN-
D.由水电离产生的c(H+)=10-12 mol·L-1的溶液:NH4+,SO42-、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=________,该反应是_________反应(填“放热”或“吸热”)。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe2O3、CO各4.0 mol,反应经过20min后达到平衡。求该时间范围内反应的平均反应速率v(CO)=__________、CO的平衡转化率=__________。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________
A.降低反应温度 B.增加Fe2O3的量 C.加入合适的催化剂 D.移出部分CO2 E.减小容器的容积
(4)在1L的密闭容器中,1150℃条件,下列达平衡状态的是__________。
A | B | C | D | |
n(Fe2O3) | 0.350 | 0.027 | 0.080 | 0.080 |
n(CO) | 0.010 | 0.010 | 0.010 | 0.050 |
n(Fe) | 0.100 | 0.064 | 0.080 | 0.080 |
n(CO2) | 0.035 | 0.088 | 0.037 | 0.050 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质能满足如图所示转化关系的是(图中箭头表示进一步转化)
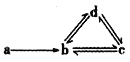
a | b | c | d | |
① | Si | SiO2 | H2SiO3 | Na2SiO3 |
② | Al | AlCl3 | NaAlO2 | Al(OH)3 |
③ | Cu | CuO | Cu(OH)2 | CuSO4 |
④ | Fe2O3 | FeCl3 | FeCl2 | Fe |
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g))![]() 2SO3(g)反应过程的能量变化如图所示,已知1molSO2(g)被氧化为1molSO3(g)的ΔH=-akJ/mol(a﹥0)。回答下列问题:
2SO3(g)反应过程的能量变化如图所示,已知1molSO2(g)被氧化为1molSO3(g)的ΔH=-akJ/mol(a﹥0)。回答下列问题:

(1)图中A表示:__,E的大小对该反应的反应热ΔH__(填“是”或“否”)有影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点__(填“升高”或“降低”),理由是__。
(2)图中ΔH=__kJ/mol。
(3)在一定温度下,将2molSO2和1molO2放在一密闭容器中,在催化剂作用下充分反应。测得反应放出的热量__(填“等于”、“大于”或“小于”)2akJ。
(4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自己被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
①__;②4VO2+O2=2V2O5
(5)已知固态单质硫的燃烧热为bkJ/mol,计算由S(s)生成3molSO3(g)的ΔH=___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com