
| 弱酸 | HCOOH | HCN | H2S |
| 电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
| A. | NaHS溶液中加入适量KOH后:c(Na+)═c(H2S)+c(HS-)+2C(S2-) | |
| B. | HCOO-、CN-、HS-在溶液中不可以大量共存 | |
| C. | 等体积、等浓度的HCOONa和NaCN两溶液中所含离子数目前者大于后者 | |
| D. | 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 |
分析 图表中数据分析可知,酸性大小为:HCOOH>H2S>HCN>HS-,
A.溶液中存在物料守恒,n(Na)=n(S);
B.HCOO-、CN-、HS-离子都是弱酸阴离子,酸性HCOOH>HS-,离子间不发生反应;
C.等体积、等浓度的HCOONa和NaCN两溶液中阴离子水解程度不同,水的电离程度不同,结合电荷守恒分析判断;
D.等体积、等pH的HCOOH和HCN溶液中,HCN溶液溶质浓度大;
解答 解:A.NaHS溶液中加入适量KOH后反应生成硫化钾和硫化钠,但硫化钠溶液中存在物料守恒,c(Na+)═c(H2S)+c(HS-)+C(S2-),故A错误;
B.酸性HCOOH>HS-,离子间不发生反应,HCOO-、CN-、HS-在溶液中可以大量共存,故B错误;
C.HCOO-水解程度小于CN-,则HCOONa溶液中氢氧根离子浓度小于NaCN溶液中氢氧根离子浓度,溶液中存在电荷守恒:c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),钠离子浓度相同,HCOONa溶液中氢离子浓度大于NaCN溶液中氢离子浓度,则HCOONa溶液中离子总浓度大于NaCN溶液中离子总浓度,故C正确;
D.等体积、等pH的HCOOH和HCN溶液中,HCN溶液溶质浓度大,恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故D错误;
故选C.
点评 本题考查了弱电井电离平衡、电离程度大小比较和盐类水解的应用、电解质溶液中电荷守恒、物料守恒分析,掌握基础是解题关键,题目难度中等,侧重于考查学生的分析能力和应用能力.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
 氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2•H2O也是一元弱碱,25℃时电离常数Kb=4.0×10-5.现用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示.下列说法正确的是( )
氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2•H2O也是一元弱碱,25℃时电离常数Kb=4.0×10-5.现用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示.下列说法正确的是( )| A. | 甲胺在水中的电离方程式为:CH3NH2•H2O═CH3NH3++OH- | |
| B. | A、B、C三点溶液中,水电离出来的c(H+):B>C>A | |
| C. | C点所在溶液中$\frac{c(C{H}_{3}N{H}_{2}•{H}_{2}O)}{c(C{H}_{3}N{H}_{3}^{+})}$=2.5×10-5 | |
| D. | B点溶液中存在c(CH3NH2•H2O)>c(CH3NH3+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol•L-1盐酸、③0.1 mol•L-1氯化镁溶液、④0.1 mol•L-1硝酸银溶液中,Ag+浓度:①>④=②>③ | |
| B. | 将NH4HCO3、AlCl3、FeCl2、KAl(SO4)2的溶液分别加热蒸干、灼烧,均不能得到原物质 | |
| C. | 可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小 | |
| D. | 25℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:pKa=-lgKa,25℃时,H2SeO3的 pKa1=1.34,pKa2=7.34.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SeO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2SeO3的 pKa1=1.34,pKa2=7.34.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SeO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )| A. | a点所得溶液中:2c(H2SeO3)+c(SeO32-)<0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SeO3)+c(H+)=c(SeO32-)+c(OH-) | |
| C. | c点所得溶液中:c(Na+)<3c(HSeO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SeO32-)>c(HSeO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,X的化学式为Fe3C.
,X的化学式为Fe3C.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
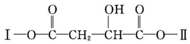 (其中Ⅰ、Ⅱ为未知部分的结构).
(其中Ⅰ、Ⅱ为未知部分的结构).
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 序号 | 步骤 | 现象 |
| I | 向图2装置内充SO2气体 | G中:有气泡冒出,产生白色沉淀;H中:有气泡冒出,产生白色沉淀;液面上方先略显红棕色,后逐渐消失 |
| Ⅱ | 从G、H中过滤出白色沉淀,分别加入稀盐酸中 | G、H中的白色沉淀均不溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 8种 | C. | 10种 | D. | 14种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com