
| A. | 苯 | B. | 乙烯 | C. | 乙烷 | D. | 乙酸 |
科目:高中化学 来源: 题型:选择题
| A. | 把抗氧化剂作为食品添加剂可减缓食物变质的速率 | |
| B. | 金属钾、钠、镁着火时,不能用泡沫灭火器灭火 | |
| C. | PM 2.5粉尘中常含Pb、Cd、Cr、V、As等对人体有害的金属元素 | |
| D. | 用激光笔分别照射装有蓝墨水、淀粉溶液的玻璃杯均出现光亮通路 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
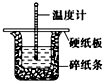 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | a | |||||||
| 二 | d | e | h | |||||
| 三 | b | c | f | g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
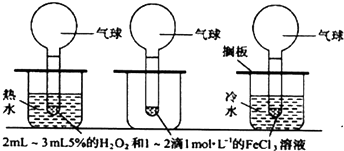
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要有能量变化,则一定发生了化学反应 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 所有单质和化合物中,一定存在化学键 | |
| D. | 酸碱中和反应一定是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com