
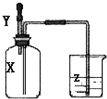
 如图所示,集气瓶内充满某气体X,将滴管内的溶液Y挤入集气瓶后,烧杯中的溶液Z会进入集气瓶,然后又会有溶液被压回烧杯,则下列组合正确的是( )
如图所示,集气瓶内充满某气体X,将滴管内的溶液Y挤入集气瓶后,烧杯中的溶液Z会进入集气瓶,然后又会有溶液被压回烧杯,则下列组合正确的是( )| ① | X是甲烷,Y是高锰酸钾溶液,Z水 |
| ② | X是HCl,Y是浓硫酸,Z溴水 |
| ③ | X是氨气,Y是盐酸,Z浓氢氧化钠溶液 |
| ④ | X是SO2,Y是氢氧化钠溶液,Z浓硫酸 |
| A、①② | B、②④ | C、③④ | D、②③ |


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:
A、硝基苯的结构简式: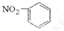 | ||
B、NH4Cl的电子式: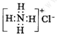 | ||
C、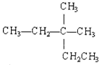 的名称为:3,3二甲基戍烷 的名称为:3,3二甲基戍烷 | ||
D、具有16个质子、16个种子和18个电子的微粒一定是
|
查看答案和解析>>
科目:高中化学 来源: 题型:
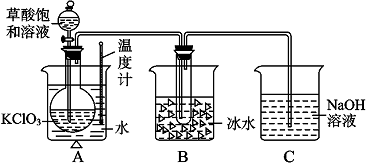
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入加入足量0.1mol?L-1 CH3COOH. | |
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源: 题型:
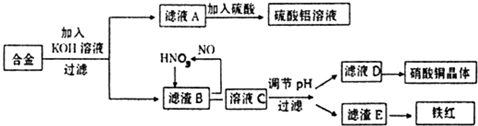
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
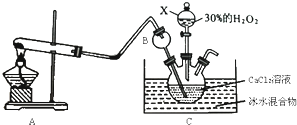
查看答案和解析>>
科目:高中化学 来源: 题型:
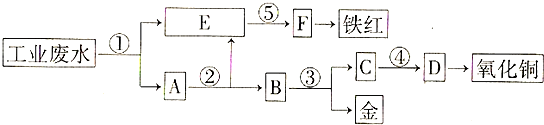
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | H3PO4 | K1=7.11×10-3 |
| H3PO3 | K1=3.7×10-2 | K2=6.23×10-8 | |
| K2=2.9×10-7 | K3=4.5×10-13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com