
【题目】用0.1mol/LNaOH溶液分别滴定体积均为20mL,浓度均为0.1mol/LHCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图。下列说法正确的是
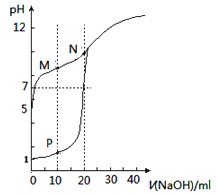
A. M点c(HX)-c(X-)>c(OH-)-c(H+)
B. N点的pH>7的原因是由于NaOH过量所致
C. HX为弱酸,且电离平衡常数Ka≈1×10-10
D. P点c(Cl-)=0.05mol/L
【答案】A
【解析】
A.M点为等浓度NaX、HX混合溶液,且溶液呈碱性,说明X-的水解程度大于HX的电离程度,由物料守恒可知:2c(Na+)=c(X-)+c(HX),结合电荷守恒c(Na+)+c(H+)= c(X-)+c(OH-),联立可得:c(X-)+c(HX)+2c(H+)=2c(X-)+2c(OH-),整理得:c(HX)-c(X-)=2c(OH-)-2c(H+)> c(OH-)-c(H+),A正确;
B.N点溶液为NaX溶液,该盐是强碱弱酸盐,X-发生水解,消耗水电离产生的H+,促进了水的电离,最终达到平衡时c(OH-)>c(H+),溶液显碱性,B错误;
C.0.1mol/L的HX的pH=5,c(H+)=10-5mol/L,根据电离平衡常数的定义可得K=![]() ,C错误;
,C错误;
D.P点溶液为NaCl、HCl按1:1物质的量的混合溶液,c(Cl-)=![]() ,D错误;
,D错误;
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】火法炼铜是目前世界上最主要的冶炼铜的方法,其产量可占到铜总产量的85%以上,火法炼铜相关的方程式有
Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H1=-271.4kJ/mol 反应①
Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g) △H2=+123.2kJ/mol 反应②
(1)Cu2S(s)在空气中煅烧生成Cu2O(s)和SO2(g)的热化学方程式是___。
(2)火法炼铜所得吹炼烟气中SO2含量较高,该烟气在工业上可直接用于生产硫酸,从绿色化学角度考虑其优点有____(任写一条)。
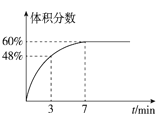
(3)在2L的恒温密闭容器中通入5mol氧气并加入足量Cu2S发生反应①(不考虑其它反应),容器中的起始压强为akPa,反应过程中某气体的体积分数随时间变化如图所示,反应前3min平均反应速率v(SO2)=___mol/(L·min),该温度下反应的平衡常数KP=___(KP为以分压表示的平衡常数)。若保持温度不变向平衡体系中再通入1mol氧气,达到新平衡后氧气的体积分数___(填“大于”“小于”或“等于”)原平衡时氧气的体积分数。
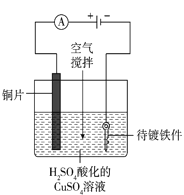
(4)工业上电镀铜的装置如图所示,阳极产物除Cu2+外还有部分Cu+,部分Cu+经过一系列变化会以Cu2O的形式沉积在镀件表面,导致镀层不够致密、光亮。电镀过程中用空气搅拌而不是氮气搅拌的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要用NaCl固体配制100mL 2.0mol·L-1的NaCl溶液,试回答下列各题:
(1)下列仪器中,不会用到的是 _____________。
A.锥形瓶 B.100mL容量瓶 C.量筒 D.胶头滴管 E.50mL容量瓶 F.天平
(2)若要实施配制,除上述仪器外,尚缺的仪器或用品是___________________。
(3)容量瓶在使用前必须____________________________________。
(4)人们常将配制过程简述为以下各步骤:
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移
其正确的操作顺序应是_____________________________(填各步骤序号)。
(5)配制完毕后,教师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是 (_________)
A.称量 NaCl固体时“左码右物”
B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(6)通过计算可得出可用托盘天平称取NaCl固体质量是______________。若用5.0mol/L的NaCl溶液配制应用量筒量取________________mL该溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3H2O2 + 2H2CrO4 =2 Cr(OH)3 + 3O2 ↑+ 2H2O
(1)其中Cr被___________,H2O2作____________剂。
(2)_____________是氧化产物,_______________发生还原反应。
(3)反应转移了0.3mol电子,则产生的气体在标准状态下体积约为__________。
(4)用单线桥标明电子转移的方向和数目。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其电极a常用掺有石墨烯的S8材料,电极反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法正确的是
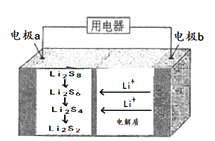
A. 电池工作时,外电路中流过0.02mol电子,负极材料减重0.14g
B. 电解池中加入少量硫酸增强导电性
C. 电池充电时间越长,电池中的Li2S2量越多
D. 电池工作时,负极可发生反应: 2Li2S6+2Li++2e-=3Li2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体在标况下的密度为__________g/L。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于0.1L水中(水的密度:1g·mL-1,且不考虑反应),其溶液中溶质的质量分数为_____。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 钠与水反应:2Na +2H2O = 2Na++2OH-+H2↑
B. 氯气通入水中:Cl2 +H2O= 2H++ClO-+Cl-
C. 硫酸溶液与氢氧化钡溶液:H+ + SO42- + Ba2++ OH-=BaSO4↓ + H2O
D. Na2O 加入稀硫酸中:O2-+2H+ = H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化剂及军事科学中。所谓“纳米材料”是指研究、开发出的微粒直径从几纳米到几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物可能具有的性质是 _______________________。
A.所得液体能全部透过半透膜 B.能全部透过滤纸
C.有丁达尔效应 D.所得物质一定是悬浊液
(2)把淀粉溶液溶于沸水中,制成淀粉胶体,鉴别溶液和淀粉胶体可以利用的方法是______________。
(3)把少量的FeCl3饱和溶液滴入沸水中,制成Fe(OH)3胶体,制备氢氧化铁胶体的化学方程式为_____________________,向氢氧化铁胶体中滴入稀硫酸至稀硫酸过量可观察到的现象是_______________________________,写出上述反应的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2 + O2![]() 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
A. 等于p%B. 大于p%C. 小于p%D. 无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com