
 25℃时,氢氟酸的电离常数Ka=6.8×10-4mol•L-1,醋酸的电离常数Ka=1.8×10-5mol•L-1,如图表示25℃时氟化钠和醋酸钠溶液的浓度和Y的关系,则Y可以表示( )
25℃时,氢氟酸的电离常数Ka=6.8×10-4mol•L-1,醋酸的电离常数Ka=1.8×10-5mol•L-1,如图表示25℃时氟化钠和醋酸钠溶液的浓度和Y的关系,则Y可以表示( )| A. | 溶液的pH | B. | 水解平衡常数 | ||
| C. | 水解百分率 | D. | 溶液中阴离子浓度之和 |
分析 25℃时,氢氟酸的电离常数大于醋酸的电离平衡常数,可知氢氟酸的酸性大于醋酸,氟化钠的水解程度小于醋酸钠.
A.等物质的量浓度的氟化钠和醋酸钠溶液,醋酸钠溶液的碱性更强,pH更大;
B.水解平衡常数只受到温度的影响,不受盐溶液浓度的大小影响;
C.随着盐溶液浓度的增大,水解程度越来越小;
D.根据电荷守恒去判断等物质的量浓度的氟化钠和醋酸钠溶液中阴离子浓度之和的相对大小.
解答 解:A.等物质的量浓度的氟化钠和醋酸钠溶液水解呈碱性,随着盐浓度的增大,溶液碱性越强,由于氟化钠的水解程度小于醋酸钠,醋酸钠溶液的碱性更强,pH更大,与图象相符,故A正确;
B.水解平衡常数只受到温度的影响,不受盐溶液浓度的大小影响,与图象不符,故B错误;
C.随着盐溶液浓度的增大,水解程度越来越小,与图象不符,故C错误;
D.根据电荷守恒可知溶液中阴离子浓度之和等于钠离子浓度和氢离子浓度之和,等物质的量浓度的氟化钠和醋酸钠溶液相比,钠离子浓度相等,由于醋酸钠溶液水解程度大,则醋酸钠溶液中氢离子浓度小,因此醋酸钠溶液中阴离子浓度之和比氟化钠溶液中的小,与图象不符,故D错误;
故选A.
点评 本题考查了盐类水解的规律,难度中等,能通过Ka的大小得到酸性的强弱,然后根据“越弱越水解”的规律得到盐类水解程度的大小是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 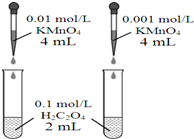 依据褪色快慢比较浓度对反应速率的影响 | |
| B. | 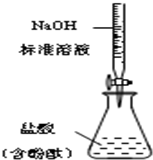 测定盐酸浓度 | |
| C. | 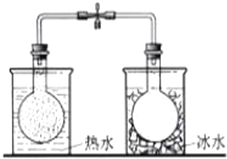 依据气体颜色变化,证明温度对平衡移动的影响 | |
| D. | 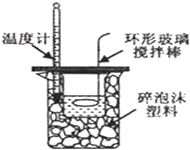 中和热的测定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③⑤ | C. | ③⑤⑥ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHRO3溶液中(R表示S或C):c(Na+)>c(HRO3-)>c(OH-)>c(H+)>c(RO32-) | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后呈中性,则混合溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② | |
| D. | 等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数:N前>N后 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com