
| A. | 电解精炼铜时,阴极质量增加6.4g,电路中电子转移的总数为0.2NA | |
| B. | 6.0gSiO2晶体中含有0.2NA个Si-O键 | |
| C. | 10g 46%乙醇溶液中含氧原子0.1NA | |
| D. | 苯与液溴反应生成1mol 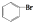 时消耗0.5NA个Br2 时消耗0.5NA个Br2 |
分析 A、电解精炼铜时,阴极上铜离子放电:Cu2++2e-=Cu;
B、求出二氧化硅的物质的量,然后根据1mol二氧化硅中含4mol硅氧键来分析;
C、乙醇溶液中,除了乙醇外,水也含氧原子;
D、苯与液溴发生取代反应.
解答 解:A、电解精炼铜时,阴极上铜离子放电:Cu2++2e-=Cu,故当阴极上有6.4g铜析出即0.1mol铜析出时,转移0.2NA个电子,故A正确;
B、6.0g二氧化硅的物质的量为0.1mol,而1mol二氧化硅中含4mol硅氧键,故0.1mol二氧化硅中含0.4NA个硅氧键,故B错误;
C、乙醇溶液中,除了乙醇外,水也含氧原子,故溶液中的氧原子的个数多于0.1NA个,故C错误;
D、苯与液溴发生取代反应,生成1mol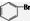 时消耗NA个Br2,故D错误;
时消耗NA个Br2,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
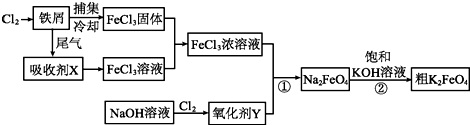
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 58.5 g氯化钠中约含有6.02×1023个氯化钠分子 | |
| B. | 常温常压下,2.24LC2H4中含有共用电子对的数目为0.6NA | |
| C. | 0.1molNa2O2与足量的水反应,转移电子数为0.2NA | |
| D. | 200mL 0.5 mol•L-1的Na2CO3溶液中CO32-离子数目小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
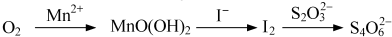
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 | |
| B. | Zn2+的最外层电子排布式为3s23p63d10 | |
| C. | 基态铜原子的外围电子排布图: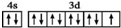 | |
| D. | 基态碳原子的最外层电子排布图: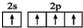 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| B. | 小苏打用于治疗胃溃疡病人的胃酸过多症 | |
| C. | 计算机芯片所用的材料是高纯度的二氧化硅 | |
| D. | 捕获工业排放的CO2能降低地球的温室效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com