
�������£�����������Һ��0.1mol/LNH4Cl ��0.1mol/LCH3COONH4 �� 0.1mol/ L NH4HSO4 ��0.1mol/LNH3��H2O��0.1mol/LNH4Cl�Ļ����Һ ��0.1mol/LNH
0.1mol/ L NH4HSO4 ��0.1mol/LNH3��H2O��0.1mol/LNH4Cl�Ļ����Һ ��0.1mol/LNH 3��H2O
3��H2O
(1)��Һ�ٳ�___�ԣ���ᡱ������С�����ԭ����____________________________(�����ӷ���ʽ��ʾ)
(2 )�Ƚ���Һ�ڡ�����C(NH4+)�Ĵ�С��ϵ��____________________(��>,<��=)
)�Ƚ���Һ�ڡ�����C(NH4+)�Ĵ�С��ϵ��____________________(��>,<��=)
(3)����Һ���У�_____________���ӵ�Ũ��Ϊ0.1mol/L
NH3��H2O��_________���ӵ����ʵ���Ũ��֮��Ϊ0.2mol/L
(4) �����²����Һ�ڵ�PH=7����˵��CH3COO-��ˮ��̶�_______(��>,<��=")" NH4+��ˮ��̶�,C(CH3COO-)_________C(NH4+)(��>,<��=)
 â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����A��B��C��D��E�������ӻ������γɵ���Һ���ֱ���K+��NH4+��Ag+��Ba2+��Fe3+��Cl-��OH-��CO32-��SO42-��NO3-�е������Ӻ������Ӹ�һ����ɣ��������ӻ������������������Ӹ�����ͬ������֪��������ʱ��0.1 mol��L-1B��Һ��pH=10����C��D��E������Һ��pH��С��7����C��Һ�ֱ�������������Һ��Ӧ�����ɳ�������A��Һ��D��Һ�ڼ��������·�Ӧ�Ȳ�����ɫ�����ֲ����̼�����ζ�����壬���ɵİ�ɫ����������ϡ���ᡣ
��1���Ը�������ʵ����ʵ�����ƶϣ��û�ѧʽ��ʾ��
BΪ_________��CΪ_________��DΪ________��
��2��д�����з�Ӧ�����ӷ���ʽ��
A��Һ��D��Һ��ϣ����ȣ� ��
C��Һ��E��Һ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꺣��ʡ�����мλ���ѧ�߶��½�ѧ����������ѧ������������ ���ͣ������
��ѧѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ���ˮ��ƽ�����֣��Ҿ�������������ԭ������ش��������⣺
���ں����ܱ������У�������Ӧ3A(g)��B(g) 2C(g)����H��Q kJ/mol���ش��������⣺
2C(g)����H��Q kJ/mol���ش��������⣺
��1��д���÷�Ӧƽ�ⳣ���ı���ʽ__________��
��2�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������________(�����)��
�� v(A)��3v(B) �ڻ��������ܶȱ��ֲ��䡡
����3 mol A���ĵ�ͬʱ��1 mol B���ɡ� ��C��Ũ�ȱ��ֲ���
��3������ʵ���õ����ݿ�֪���¶�Խ�߸÷�Ӧ�Ļ�ѧƽ�ⳣ��Խ����Q______0(����ڡ���С�ڡ�)��
��1�������£�ȡpH��2������ʹ�����Һ��100 mL�������зֱ����������Zn������Ӧ����������Һ��pH�仯��ͼ��ʾ����ͼ�б�ʾ������Һ��pH�仯���ߵ���________(�� ��a����b��)���������м���Zn����Ϊm1��������Һ�м����Zn����Ϊm2����m1________m2(ѡ�����������������)��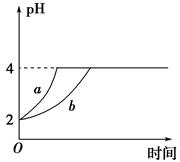
��2����������pH��2������ʹ�����Һ�� 100 mL���ֱ��ˮϡ�ͺ�ʹpH��4���������м���ˮ�����ΪV1��������Һ�м����ˮ�����ΪV2���� V1______V2(���������������)��
�����£�Ũ�Ⱦ�Ϊ0.1 mol/L ������������Һ��pH���±���
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�캣��ʡ�����и߶��½�ѧ����������ѧ���������棩 ���ͣ������
��ѧѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ���ˮ��ƽ�����֣��Ҿ�������������ԭ������ش��������⣺
���ں����ܱ������У�������Ӧ3A(g)��B(g) 2C(g)����H��Q kJ/mol���ش��������⣺
2C(g)����H��Q kJ/mol���ش��������⣺
��1��д���÷�Ӧƽ�ⳣ���ı���ʽ__________��
��2�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������________(�����)��
�� v(A)��3v(B) �ڻ��������ܶȱ��ֲ��䡡
����3 mol A���ĵ�ͬʱ��1 mol B���ɡ� ��C��Ũ�ȱ��ֲ���
��3������ʵ���õ����ݿ�֪���¶�Խ�߸÷�Ӧ�Ļ�ѧƽ�ⳣ��Խ����Q______0(����ڡ���С�ڡ�)��
��1�������£�ȡpH��2������ʹ�����Һ��100 mL�������зֱ����������Zn������Ӧ����������Һ��pH�仯��ͼ��ʾ����ͼ�б�ʾ������Һ��pH�仯���ߵ���________(�� ��a����b��)���������м���Zn����Ϊm1��������Һ�м����Zn����Ϊm2����m1________m2(ѡ�����������������)��

��2����������pH��2������ʹ�����Һ�� 100 mL���ֱ��ˮϡ�ͺ�ʹpH��4���������м���ˮ�����ΪV1��������Һ�м����ˮ�����ΪV2���� V1______V2(���������������)��
�����£�Ũ�Ⱦ�Ϊ0.1 mol/L ������������Һ��pH���±���
|
���� |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
��1����������Һ�е������ӣ����H+������ǿ����
��2�����ݱ��������жϣ�Ũ�Ⱦ�Ϊ0.01 mol/L �������������ʵ���Һ�У�������ǿ����_______ �����ţ� �� ������Һ�ֱ�ϡ��100���� pH�仯��С���� �����ţ� ��
A��HCN B��HClO C��C6H5OH D��CH3COOH E��H2CO3
��3�����ϱ����ݣ������ж����з�Ӧ���ܳ������� �����ţ���
A��CH3COOH�� Na2CO3��NaHCO3��CH3COONa
B��CH3COOH��NaCN��CH3COONa��HCN
C��CO2��H2O��2C6H5 ONa��Na2CO3��2C6H5OH
������֪��ZnCl2��xH2O������ˮ������Ũ��ˮ��Һ�ʽ�ǿ���ԣ�SOCl2 (�Ȼ�����)����ˮ�������·�Ӧ��SOCl2��H2O=SO2��2HCl��ʵ��������ȡ��ˮ�Ȼ�п����ZnCl2��xH2O��SOCl2��ϼ��ȵķ������Իش�
SOCl2��������___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�������ʡ��������У�߶���ѧ����ĩ������ѧ���� ���ͣ�ʵ����
��10�֣�����֪��������ȩ�ķе�Ϊ20.8�棬����ˮ���ܡ���HgSO4����������75�����ң���Ȳ��ˮ��Ϊ��ȩ����HgSO4����ijЩ�ض����ʳ��ᷢ�������ж���ʧȥ�����ã�H2S��������һ�֣�������Ȳˮ������ֻ�ÿ�״��ʯ��Ũ���ᡢˮ��NaOH��Һ��HgO��ĩ����������ȡ��ȩ��װ������ͼ��ʾ����ش��������⣻
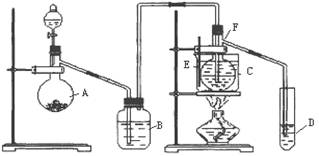
��1��ʵ�鿪ʼʱ������A��ʢ�ŵ�ʯ��B��Ӧװ ���������� ��
��2������D��ʢ��ˮ���������� ����
��3��������ƿF��Ӧ����HgO�����������Լ�,�������߷ֱ�ֱ�Ӽ��룬�밴������Ⱥ�˳��д������HgO���ڵĸ��Լ������� ����HgO�ӷŵ�F�еIJ��������� ��
��4��װ��ͼ�У�����F�ķ����� ����ѡ���¶ȼ�F�����̱�ʾ��ȷ����
������ţ���
A��0�桫50�� B��0�桫100�� C��0�桫200�桡��D�� 0�桫360��
��5��������ȩ���Ƴ��IJ�����������
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��ѧѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ���ˮ��ƽ�����֣��Ҿ�������������ԭ������ش��������⣺
���ں����ܱ������У�������Ӧ3A(g)��B(g)![]() 2C(g)����H��Q kJ/mol���ش��������⣺
2C(g)����H��Q kJ/mol���ش��������⣺
��1��д���÷�Ӧƽ�ⳣ���ı���ʽ__________��
��2�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������________(��
���)��
�� v(A)��3v(B) �ڻ��������ܶȱ��ֲ��䡡
����3 mol A���ĵ�ͬʱ��1 mol B���ɡ� ��C��Ũ�ȱ��ֲ���
��3������ʵ���õ����ݿ�֪���¶�Խ�߸÷�Ӧ�Ļ�ѧƽ�ⳣ��Խ����Q______0(����ڡ���С�ڡ�)��
��1�������£�ȡpH��2������ʹ�����Һ��100 mL�������зֱ����������Zn������Ӧ����������Һ��pH�仯��ͼ��ʾ����ͼ�б�ʾ������Һ��pH�仯���ߵ���________(�a����b��)���������м���Zn����Ϊm1��������Һ�м����Zn����Ϊm2����m1________m2(ѡ�����������������)��


��2����������pH��2������ʹ�����Һ�� 100 mL���ֱ��ˮϡ�ͺ�ʹpH��4���������м���ˮ�����ΪV1��������Һ�м����ˮ�����ΪV2���� V1______V2(���������������)��
�����£�Ũ�Ⱦ�Ϊ0.1 mol/L ������������Һ��pH���±���
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
��1����������Һ�е������ӣ����H+������ǿ����
��2�����ݱ��������жϣ�Ũ�Ⱦ�Ϊ0.01 mol/L �������������ʵ���Һ�У�������ǿ����_______ �����ţ� �� ������Һ�ֱ�ϡ��100���� pH�仯��С���� �����ţ� ��
A��HCN B��HClO C��C6H5OH D��CH3COOH E��H2CO3
��3�����ϱ����ݣ������ж����з�Ӧ���ܳ������� �����ţ���
A��CH3COOH�� Na2CO3��NaHCO3��CH3COONa
B��CH3COOH��NaCN��CH3COONa��HCN
C��CO2��H2O��2C6H5ONa��Na2CO3��2C6H5OH
������֪��ZnCl2��xH2O������ˮ������Ũ��ˮ��Һ�ʽ�ǿ���ԣ�SOCl2 (�Ȼ�����)����ˮ�������·�Ӧ��SOCl2��H2O=SO2��2HCl��ʵ��������ȡ��ˮ�Ȼ�п����ZnCl2��xH2O��SOCl2��ϼ��ȵķ������Իش�
SOCl2��������___________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com