
| A. | 液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质 | |
| B. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 | |
| C. | 氢氧化铁胶体的电泳实验能证明氢氧化铁胶体带正电 | |
| D. | 在体积相同的两个密闭容器中分别充满O2和O3气体,当这两个容器内温度和气体密度相等时,两种气体的氧原子数目相等 |
分析 A、根据电解质和非电解质的定义:电解质是指在水溶液中或在熔融状态下就能够导电(电解离成阳离子与阴离子)的化合物,非电解质是指在水溶液中或在熔融状态下就不能导电的化合物判断;
B、根据萃取剂的选择标准分析;
C、胶体不带电;
D、相同体积相同密度时,两容器气体的质量相等,且都由O元素组成,则O原子的质量、个数以及物质的量相等.
解答 解:A、液态HCl不导电,但在水溶液中电离出氢离子和氯离子,可以导电;固态NaCl不导电,在水溶液中或熔融状态下电离出钠离子和氯离子,可以导电,所以所以HCl、NaCl均是电解质,故A错误;
B、萃取剂的选取标准是:与水互不相溶,被萃取的物质在该溶剂中的溶解度比在水中的溶解度大,且跟萃取物不发生化学反应.根据萃取剂的选择标准分析:CCl4与水不互溶;而且溴在CCl4中的溶解度比在水中的大很多,所以可用CCl4作萃取剂.但是酒精与水互溶,不能做萃取剂,故B错误;
C、胶体不带电,胶粒带电,故C错误;
D、相同体积相同密度时,两容器气体的质量相等,且都由O元素组成,则O原子的质量、个数以及物质的量相等,故D正确.
故选D.
点评 本题考查电解质的判断,胶体的性质,萃取剂的选取以及阿伏加德罗定律及其推论,难度不大,注意知识的积累.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏、裂化和煤的干馏都是化学变化 | |
| B. | 在一定条件下,苯与浓溴水、浓硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| C. | 尼龙、棉花、天然橡胶、ABS树脂都是由高分子化合物组成的物质 | |
| D. | 开发核能、太阳能等新能源,推广乙醇汽油,使用无磷洗涤剂都可直接降低碳排放量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
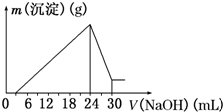 铝是现今人类生产生活中使用广泛性仅次于铁的重要金属.工业上常以“钒土矿”为原料来冶炼金属铝.已知:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质).为了检测某“钒土矿”样中Al2O3的含量,进行了如下实验过程:
铝是现今人类生产生活中使用广泛性仅次于铁的重要金属.工业上常以“钒土矿”为原料来冶炼金属铝.已知:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质).为了检测某“钒土矿”样中Al2O3的含量,进行了如下实验过程:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com