
 2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
科目:高中化学 来源:不详 题型:单选题
| A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 |
| C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
| D.传统的硅酸盐工业为人类提供了大量的建筑等材料。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
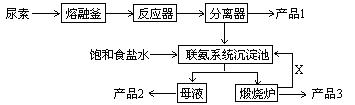
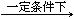 C3N6H6 + 6NH3 + 3CO2
C3N6H6 + 6NH3 + 3CO2查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4NO(g)+6H2O(l) △H<0
4NO(g)+6H2O(l) △H<0 2NO2(g) △H<0
2NO2(g) △H<0 2HNO3(l) +NO(g) △H<0
2HNO3(l) +NO(g) △H<0| A.适当升高温度 | B.适当增大吸收塔内的压强 |
| C.增大空气中O2的浓度 | D.吸收塔内填充瓷环,增大气液接触面 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
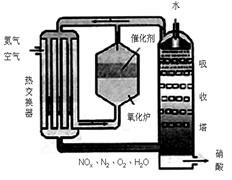
 2NH3(g) △H=" -92.4KJ/mol " ,据此回答以下问题:
2NH3(g) △H=" -92.4KJ/mol " ,据此回答以下问题:
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 式)。
式)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
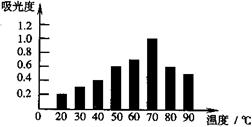
| A.20℃时,红枣中红色素含量最低 | |
| B.吸光度越大,红枣中红色素含量越高 | C.红色素可能在较高温度下不稳定 |
| D.温度越高,提取液中红色素含量越高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com