
【题目】(I)工业上常用电解饱和食盐水的方法制备氯气,其装置如下图所示:

(1)写出电解饱和食盐水的化学方程式并在化学方程式上标出电子转移的方向和数目:_____。
(2)电解时,将Y极(阳极)生成的物质通入盛有NaI溶液的试管中,再加入四氯化碳充分振荡,最后观察到的现象是____________。
A.溶液分层,上层无色,下层橙红色
B.溶液分层,上层橙红色,下层无层
C.溶液分层,上层无色,下层紫红色
D.溶液分层,上层紫红色,下层无层
(3)用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效的反应的化学方程式_______;____________________________。
(II)某同学对实验室制取氯气的装置进行改进,设计了制取无水氯化铁的实验装置图(如下),将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中。请回答下列问题:
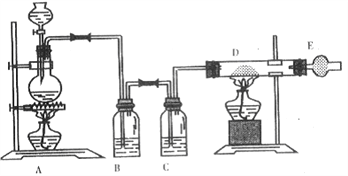
(4)烧瓶中发生反应的化学方程式____________________;
(5)产生的气体通过B、C装置,可以得到干燥纯净的氯气,B瓶中的试剂是_____________;
(6)如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要原因为______________________________________。
(7)玻璃管D中反应现象是_________________;写出反应方程式______________________。
(8)干燥管E中盛有碱石灰(CaO+NaOH),其作用是__________________。
【答案】 2NaCl + 2H2O===2NaOH + H2 + Cl2 C Ca(ClO)2+CO2+H2O = CaCO3 +2HClO 2HClO = 2HCl + O2 MnO2+4HCl(浓) = MnCl2+Cl2 ↑+2H2O 饱和NaCl溶液 反应一段时间后,盐酸浓度变稀,无法被二氧化锰氧化 剧烈燃烧,生成棕褐色的烟 3Cl2 + 2Fe=2FeCl3 除去多余Cl2,防止污染空气
【解析】本题主要考查氯气的性质。
(I)(1)写出电解饱和食盐水的化学方程式并在化学方程式上标出电子转移的方向和数目: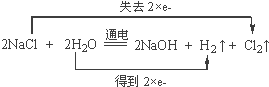 。
。
(2)阳极生成氯气,通入盛有NaI溶液的试管中,发生反应生成碘单质,再加入四氯化碳充分振荡,形成紫红色的碘的四氯化碳溶液,最后观察到的现象是溶液分层,上层无色,下层紫红色,故选C。
(3)漂白粉长期露置在空气中失效的反应的化学方程式:Ca(ClO)2+CO2+H2O = CaCO3+2HClO;2HClO![]() 2HCl+O2↑。
2HCl+O2↑。
(II)(4)烧瓶中发生反应的化学方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(5)气体的除杂通常最后一步干燥,B瓶中的试剂是用来除去氯化氢的饱和食盐水;
(6)如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要原因为反应一段时间后,盐酸浓度变稀,无法被二氧化锰氧化。
(7)玻璃管D中反应现象是剧烈燃烧,生成棕褐色的烟;反应的化学方程式:2Fe+3Cl2![]() 2FeCl3。
2FeCl3。
(8)干燥管E中盛有碱石灰(CaO和NaOH),其作用是除去多余Cl2,防止污染空气。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种安全无毒的物质,带有结晶水,通常还含有CaO。经审查,面粉中添加过氧化钙已无技术上的必要性,因此,卫生部严令禁止在面粉生产中添加等添加剂。但过氧化钙在工农业生产中广泛用作杀菌剂、防腐剂、解酸剂、油类漂白剂等。
(1)称取5.42 g过氧化钙样品,灼热时发生如下反应:
2[CaO2·xH2O] → 2CaO + O2↑+ 2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为________。
(2)另取同一样品5.42 g,溶于适量稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 7.0 g。
①样品中CaO的质量为________。
②样品中CaO2·xH2O中的x值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)。

(1)写出MgCO3分解的化学方程式__________________________。
(2)装置C的作用是__________________________,处理尾气的方法为__________。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末是_________。
②甲组步骤1中反应的离子方程式为_______________________________________________。
③乙组步骤4中,溶液变红的原因为_______________________________________________。
④从实验安全考虑,题图装置还可采取的改进措施是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁熔点是173 ℃(在100 ℃时开始升华),沸点是249 ℃,不溶于水,易溶于苯、乙醚等非极性溶剂。下列说法不正确的是( )
A. 二茂铁属于分子晶体
B. 在二茂铁结构中,C5H![]() 与Fe2+之间形成的化学键类型是离子键
与Fe2+之间形成的化学键类型是离子键
C. 已知:环戊二烯的结构式为: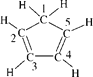 ,则其中仅有1个碳原子采取sp3杂化
,则其中仅有1个碳原子采取sp3杂化
D. C5H![]() 中一定含π键
中一定含π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物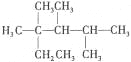 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. ![]() 与
与![]() 都是α-氨基酸且互为同系物
都是α-氨基酸且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
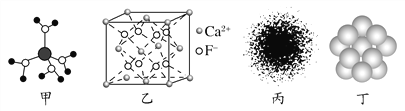
A. 水合铜离子的模型如图甲所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图乙所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图丙所示,H原子核外大多数电子在原子核附近运动
D. 金属Cu中Cu原子堆积模型如图丁所示,为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】33.6g 含杂质的Na2CO3、NaHCO3均匀混合物平均分成两份,向一份中加入250ml 1.00mol·L-1过量盐酸反应,生成标准状况下3.36L气体。将另一份充分灼烧,干燥后称得固体质量为13.7g。杂质不与酸反应,受热也不分解。求:
(1)原混合物中含有Na2CO3的物质的量。
(2)Na2CO3、NaHCO3的质量比。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com