
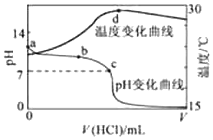
 室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14mol/L | |
| B. | b点:c(NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | b点时加入的盐酸体积小于20.00mL,而c点时加入的盐酸体积大于20.00mL | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
分析 A.根据酸碱滴定过程的图中a点的pH值来分析溶液中离子的浓度;
B.b点时pH>7,盐酸和氨水反应,氨水过量,反应后溶质为氯化铵和氨水;
C.b点时加入的盐酸体积小于20.00mL,c点时加入的盐酸体积小于20.00mL;
D.根据d点盐酸和氨水恰好完全反应,放热最多分析.
解答 解:A.因a点7<pH<14,因此水电离出的c(H+)>1.0×10-14mol•L-1,故A错误;
B.盐酸和氨水反应,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒可知c(Cl-)=c(NH4+),b点时pH>7,则氨水过量,c(NH4+)+c(NH3•H2O)>c(Cl-),因同一溶液,溶液体积相同,所以n(NH4+)+n(NH3•H2O)>n(Cl-),故B正确;
C.C点溶液呈中性,则c(H+)=c(OH-),氯化铵是强酸弱碱盐,其水溶液呈酸性,要使其水溶液呈中性,则氨水应该稍微过量,所以消耗盐酸的体积V<20 mL,b点时pH>7,则氨水过量更多,b点时加入的盐酸体积小于20.00mL,故C错误;
D.d点时盐酸和氨水恰好完全反应,放热最多,再加盐酸温度降低只能是加入盐酸的温度低于溶液温度,这才是温度下降的原因,故D错误;
故选B.
点评 本题考查水溶液中的电离平衡以及酸碱中和滴定,明确滴定曲线中各点的pH是解答的关键,并学会利用物料守恒、电荷守恒来解答此类习题.题目难度中等,


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:实验题

| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
| 第二次 | 25.00 | 0.56 | 30.56 | 30.00 |
| 第三次 | 25.00 | 0.22 | 25.11 | 24.89 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴加KSCN溶液,变为血红色,则原溶液中含有Fe3+ | |
| B. | 向某溶液中滴加NaOH溶液,生成白色沉淀,继而变为灰绿色,最终变为红褐色,则原溶液中含有Fe2+ | |
| C. | 将淀粉和氯化钠的混合溶液装入半透膜中,将半透膜浸泡在盛有蒸馏水的烧杯中,为检验半透膜是否破损,可向蒸馏水中加入硝酸银溶液来验证 | |
| D. | 硫酸亚铁溶液中,常放入一些铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
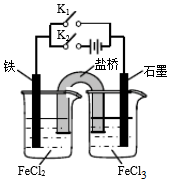
| A. | 闭合K1断开K2,左侧烧杯中的FeCl2溶液浓度逐渐增大 | |
| B. | 闭合K2断开K1,左侧烧杯中的Fe2+向铁电极移动 | |
| C. | 闭合K1断开K2,电流从石墨电极经过K1流向铁电极 | |
| D. | 无论闭合K1断开K2,还是断开K1闭合K2,石墨电极上发生的反应都是Fe3++e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0 mol | B. | 1.5mol | C. | 1.0mol | D. | 0.75mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若实验室发生火灾,应立即打开门窗(或排风扇)通风透气 | |
| B. | 实验结束后,用嘴吹熄酒精灯 | |
| C. | 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断的搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
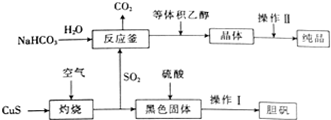 硫及其化合物在生产及生活中有着广泛的应用.
硫及其化合物在生产及生活中有着广泛的应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com