
| A、+16.3 kJ/mol |
| B、-16.3 kJ/mol |
| C、+335.7 kJ/mol |
| D、-335.7 kJ/mol |
| ||
| ||
| ||


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应速率:v(B)>v(A) |
| B、A 容器中X的转化率为80% |
| C、若打开K,则A的体积变为2.6a L |
| D、平衡时Y的体积分数:A<B |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
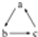 (“-→”表示反应一步完成)关系转化的是( )
(“-→”表示反应一步完成)关系转化的是( )| 选项 | a | b | c |
| A | Al2O3 | NaAlO2 | Al(OH)3 |
| B | AlCl3 | Al(OH)3 | NaAlO2 |
| C | Al | Al(OH)3 | Al2O3 |
| D | MgCl2 | Mg(OH)2 | MgO |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C3H7NO2 |
| B、C3H8NO3 |
| C、C3H7N2O2 |
| D、C3H8NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
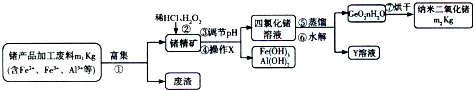
查看答案和解析>>
科目:高中化学 来源: 题型:
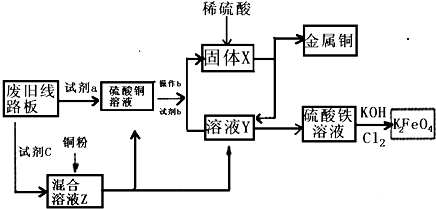 根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4).据此回答问题:
根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4).据此回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com