
【题目】(1)4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O反应中,MnO2与被氧化的HCl的物质的量之比是 ;若有6molCl2生成时,反应中转移 mol电子。
MnCl2+Cl2↑+2H2O反应中,MnO2与被氧化的HCl的物质的量之比是 ;若有6molCl2生成时,反应中转移 mol电子。
(2)把___________ g NaOH固体溶解在90 g H2O中,才能使每10个水分子中含有1个Na+,这时所得溶液中NaOH的质量分数为___________。
【答案】(1) 1:2,12;(2)20,18.2℅。
【解析】
试题分析:盐酸中氯元素的化合价在反应前后如下:HCl→MnCl2,化合价-1→-1,化合价没变化,起酸的作用;HCl→Cl2化合价由-1→0,失电子,作还原剂;所以在反应中盐酸有氧化性和酸性,由方程式知,盐酸有一半参加氧化还原反应,当生成1molCl2时,转移电子物质的量为2mole-,因此有6molCl2生成是转移电子物质的量为12mole-,故答案为:1:2; 12;
(2)根据微粒数和物质的量成正比,设NaOH的质量为xg,由每10个水分子中含有1个Na+,,则![]() :
:![]() =1:10,解得x=20g,则所得溶液中NaOH的质量分数为
=1:10,解得x=20g,则所得溶液中NaOH的质量分数为![]() ×100%=18.2%,故答案为:20;18.2%。
×100%=18.2%,故答案为:20;18.2%。


科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F可发生如下图所示的转化(反应过程中部分产物已省略)。其中化合物A由两种元素组成,且1.200 g A与足量空气充分煅烧得到0.800 g B和1.280 g D,溶液C可以清洗印刷电路板,D是一种能使澄清石灰水变浑浊的气体。请回答下列问题。
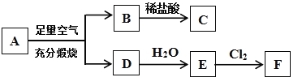
(1)A的组成元素是 。
(2)写出A → B +D的化学方程式 。
(3)写出E → F在溶液中发生的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将30ml0.5mol/L的NaOH溶液加水稀释到500ml,稀释后从中取10ml,则取出的NaOH溶液物质的量浓度为
A. 0.003mol/L B. 0.03mol/L C. 0.05mol/L D. 0.04mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的( )
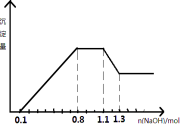
A.溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+
B.溶液中一定不含CO32-和NO3-,一定含有SO42-
C.溶液中c(NH4+)=0.3 mol/L
D.c(H+)∶c(Al3+)∶c(Mg2+)=1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式错误的是( )
A.NaHCO3═Na++H++CO32﹣
B.NaHSO4═Na++H++SO42﹣
C.Mg(NO3)2═Mg2++2NO3﹣
D.Na2SO4═2Na++SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
(1)标准状况下生成Cl2的体积___________。
(2)反应生成的MnCl2的质量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲证明一瓶无色液体是纯水,可靠的实验方法是:
A. 测得其pH=7
B. 电解时得到H2与O2的体积比为2:1
C. 遇钠生成氢气
D. 1.01× 105Pa时沸点为100℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时应将溶液蒸干
D.称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com