
【题目】某课外活动小组为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。
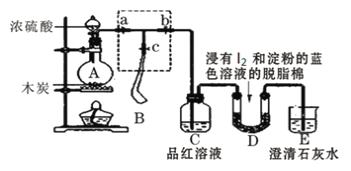
(1)装置A中盛放浓硫酸的仪器名称______________。
(2)装置A中发生反应的化学方程式为___________________________________。
(3)实验时,装置C中的现象为_______________________________________。
(4)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是_________________(用操作编号填写)。
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(5)当D中产生_________________现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;写出D中发生反应的化学方程式_______________________________________,当D中反应发生0.3mol电子转移时,发生反应的气体的体积(标准状况)是_____________L。
【答案】
(1)分液漏斗 (2分)
(2)C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O (2分,反应物和生成物的化学式全部正确得1分,其它条件、配平等正确得1分)
CO2↑+2SO2↑+2H2O (2分,反应物和生成物的化学式全部正确得1分,其它条件、配平等正确得1分)
(3)品红溶液褪色 (2分)
(4)③①② (2分)
(5)进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变(2分)
I2+SO2+2H2O=2HI+H2SO4(2分,反应物和生成物的化学式全部正确得1分,其它条件、配平等正确得1分) 3.36(2分)
【解析】
试题分析:(1)装置A中盛放浓硫酸的仪器名称为分液漏斗。(2)装置A中浓硫酸有强氧化性,能将C氧化为二氧化碳;D中碘单质能将二氧化硫氧化为硫酸,故答案为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O 。(3)反应产生的二氧化硫能使品红溶液褪色。(4)先使气体充满B,用B中气体进行试验,所以操作顺序为:③①②。(5)进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变时出气口出的是二氧化碳,所以现象为:进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变。D中二氧化硫和碘单质反应方程式为:I2+SO2+2H2O=2HI+H2SO4 。反应中1摩尔二氧化硫反应转移2摩尔电子,所以当有0.3摩尔电子转移时,有0.15摩尔的二氧化硫反应,标况下的体积为3.36L。
CO2↑+2SO2↑+2H2O 。(3)反应产生的二氧化硫能使品红溶液褪色。(4)先使气体充满B,用B中气体进行试验,所以操作顺序为:③①②。(5)进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变时出气口出的是二氧化碳,所以现象为:进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变。D中二氧化硫和碘单质反应方程式为:I2+SO2+2H2O=2HI+H2SO4 。反应中1摩尔二氧化硫反应转移2摩尔电子,所以当有0.3摩尔电子转移时,有0.15摩尔的二氧化硫反应,标况下的体积为3.36L。


科目:高中化学 来源: 题型:
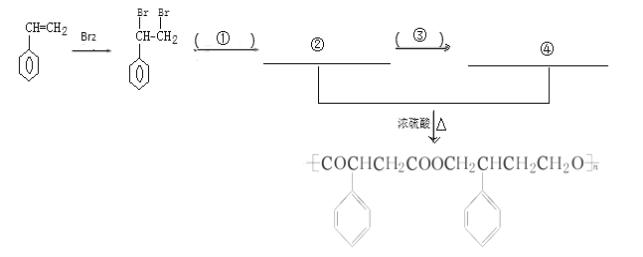
【题目】某化合物A的结构简式为![]() ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3)。C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3)。C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物A的分子式 。
(2)化合物B能发生下列反应类型的有________。
a.取代反应 b.加成反应 c.缩聚反应 d.消去反应
(3)化合物C能经下列反应得到G(分子式为C8H6O2,分子内含有五元环);

已知:(Ⅰ)RCOOH![]() RCH2OH;
RCH2OH;
(Ⅱ)经实验测定中间生成物E遇FeCl3显紫色;
(Ⅲ)R—Br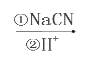 R—COOH。
R—COOH。
①确认化合物C的结构简式为__________________________。
②化合物E有多种同分异构体,其中某些同分异构体含有苯环,且苯环上有两种不同化学环境的氢,写出这些同分异构体中任意两种的结构简式:______________________________。
(4)完成下列以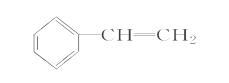 为主要原料制备
为主要原料制备
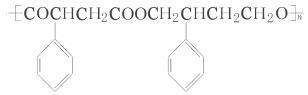 的合成路线流程图(无机试剂任选)。
的合成路线流程图(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是 。
(2)有机物E由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的E为无色粘稠液体,易溶于水。为研究E的组成与结构,通过实验得到如下信息:
①有机物E的相对分子量为90。9.0g E完全燃烧时,生成CO2 0.3mol, H2O5.4g。则有机物E的分子式为 。
②实验证实其中含有羟基,羧基,甲基,则E的结构简式为 。
③写出E与足量Na的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:


(1)常温下含碳量最高的气态烃是________(填字母)。
(2)能够发生加成反应的烃有________种。
(3)一卤代物种类最多的是________(填写字母)。
(4)写出实验室制D的化学方程式:
_____________________________________________________________
(5)写出F发生硝化反应的化学方程式:
_____________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为三种有机物的有关信息,根据表中信息回答问题.
A | B | C |
其产量用来衡量一个国家的石油化工水平. | 比例模型为:
| 沼气主要成分 |
(1)A结构简式是_____________。该物质能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色。其中,与高锰酸钾溶发生的反应是_______________(填反应类型);与溴反应的化学方程式为_____________,当溴的四氯化碳溶液质量增加2.8g时,生成物的质量为__________。
(2)工业上,B来源于煤干馏后的液态产物煤焦油.B与浓硝酸发生取代反应,该反应的化学方程式为__________。
(3)C与氯气反应能生成二氯代物,请写出该反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、硫、氯、砷等是农药中的重要组成元素。请回答下列问题:
(1)基态砷的价电子排布式是___________________________;
(2)氨气比PH3沸点高的原因是______________________;
(3)下列有关氮、磷、硫、氯的说法正确的是__________;
a.第一电离能由小到大的顺序是S<P<Cl
b.PO43-、SO42-、ClO4-互为等电子体,它们的空间构型均为四面体
c.磷、硫、氯基态原子的未成对电子数依次增多
d.1mol(C2H5O)P=0分子中含有的δ键的数目为24×6.02×1023
(4)氮化硼和磷化硼是受到高度关注的耐高温、耐磨涂料,两者结构相似。磷化硼晶胞结构如图所示,则磷化硼晶体中每个硼原子周围距离最近的磷原子数目为__________;晶体结构中存在的化学键有_______(填序号);

a.离子键b.共价键c.分子间作用力d.配位键
氮化硼晶体的熔点要比磷化硼晶体高,其原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化)。下列各组物质中,不能满足图示转化关系的是
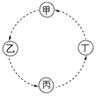
选项 | 甲 | 乙 | 丙 | 丁 |
A |
| CH2=CH2 | CH2BrCH2Br | CH2OHCH2OH |
B | NaAlO2 | Al(OH)3 | Al2O3 | Al |
C | CH3CH2OH | CH3CHO | CH3COOH | CH3COOC2H5 |
D | SiO2 | H2SiO3 | Na2SiO3 | Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4·H2O的工艺流程如下:
Ⅰ.向菱锰矿中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量MnO2,过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度。
(1)步骤Ⅰ中,滤渣的主要成分是 。
(2)将MnO2氧化Fe2+的离子方程式补充完整:
![]() MnO2 +
MnO2 +![]() Fe2++
Fe2++![]() =
=![]() Mn2+ +
Mn2+ + ![]() Fe3+ +
Fe3+ +![]()
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、 。
(4)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤Ⅲ中a的取值范围是 。
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度。
已知一定条件下,MnO4-与Mn2+反应生成MnO2 。取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学研究与工业生产中常常用到溶液中的反应。
(1)25℃时,0.05 mol·L-1Ba(OH)2溶液的pH= ,将该Ba(OH)2溶液与pH=2的HCl溶液混合,若所得混合溶液pH=7,则Ba(OH)2溶液与HCl溶液的体积比为 。
(2)CO2可转化成有机物实现碳循环:CO2![]() CH3OH
CH3OH![]() HCOOH……
HCOOH……
25 ℃时,几种酸的电离平衡常数如下:
化学式 | HCOOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
①用离子方程式表示HCOONa溶液呈碱性的原因 。
②物质的量浓度均为0.1 mol·L-1的下列四种物质:
a.Na2CO3 b.NaClO c.HCOONa d.NaHCO3 ,pH由大到小的顺序是 (填编号)。
(3)常温下,将0.2 mol·L-1的HCOOH和0.1 mol·L-1的NaOH溶液等体积混合,所得溶液的pH<7,说明所得混合溶液中HCOOH的电离程度 HCOONa的水解程度(填“大于”“等于”或“小于”)。
(4)含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-。为使废水能达标排放,做如下处理:Cr2O72-![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH)3、Fe(OH)3。若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为 mol·L-1 (已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
Cr(OH)3、Fe(OH)3。若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为 mol·L-1 (已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com