
| A、磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B、Na2S溶液呈碱性:S2-+2H2O?H2S+2OH- |
| C、向硝酸银溶液中逐滴滴入稀氨水至过量:Ag++2NH3?H2O=[Ag(NH3)2]++2H2O |
| D、Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CH3COO-)>c(Na+) |
| B、c(CH3COO-)<c(Na+) |
| C、c(CH3COO-)=c(Na+) |
| D、无法确定c(CH3COO-)与c(Na+)的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和热的测定和蒸馏均需要温度计,且温度计水银球均插入反应液中 |
| B、中和热的测定和过滤均需要玻璃棒,且玻璃棒的作用均是引流 |
| C、中和热的测定和中和滴定,均是将一种反应物逐滴滴加到另一种反应物中 |
| D、中和热的测定实验中用60mL 0.50mol?L-1盐酸和50 mL0.55mol?L-1 NaOH溶液反应,与用50mL 0.50mol?L-1 盐酸和50ml 0.55mol?L-1 NaOH溶液反应所求中和热的数值相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
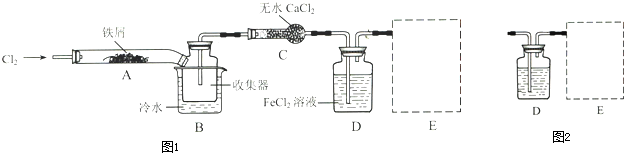
查看答案和解析>>
科目:高中化学 来源: 题型:
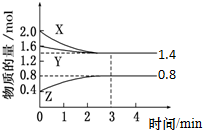 t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )
t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )| A、0~3 min,X的平均反应速率v(X)=0.1 mol?L-1?min-1 |
| B、发生反应的方程式可表示为:3 X(g)+Y(g)?2 Z(g) |
| C、3 min 时,Y的转化率为12.5%,此时,充入惰性气体Ne,转化率不变 |
| D、温度不变,增大Z的浓度,该反应的平衡常数增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com