
分析 (1)根据v=$\frac{△c}{△t}$计算反应速率;
(2)根据反应中各物质的变化的物质的量之比等于计量数之比,可写出化学方程式;
(3)根据影响化学反应速率和化学平衡的条件可作判断;
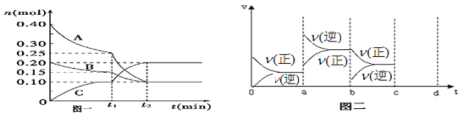
解答 解:(1)t1=10min,0至t1时间内B物质的平均反应速率v=$\frac{△c}{△t}$=$\frac{\frac{0.20mol-0.15mol}{10L}}{10min}$=5.0×10-4mol-1min-1,故答案为:5.0×10-4mol-1min-1;
(2)根据图一可知,A、B的物质的量在减小,为反应物,C的物质的量增加,为生成物,且有△n(A)=0.40mol-0.10mol=0.30mol,△n(B)=0.20mol-0.10mol=0.10mol,△n(C)=0.20mol-0mol=0.20mol,再根据反应中各物质的变化的物质的量之比等于计量数之比,可写出化学方程式为3A(g)+B(g)?2C(g),
故答案为:3A(g)+B(g)?2C(g);
(3)根据图二可知,在a时刻,正逆反应速率都增大,且逆反应速率大于正反应速率,即平衡逆向移动,因为反应的△H<0,根据影响化学反应速率和化学平衡的条件可知,a~b过程中改变的条件可能是升温;在b时刻,正反应速率 不变,逆反应速率减小,且正反应速率大于逆反应速率,即平衡正向移动,根据影响化学反应速率和化学平衡的条件可知,b~c过程中改变的条件可能是减小生成物C的浓度,故答案为:升温,减小生成物C的浓度.
点评 本题考查了根据图象写化学方程式、计算反应速率及影响反应速率和化学平衡移动的外界因素等知识,难度不大,在看图二时要注间线的起点和正逆反应速率的相对大小,进而判断平衡移动方向.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NaB溶液中水电离的OH-浓度大于10-7 mol/L | |
| B. | NaB溶液中:c(Na+)>c(B-)>c(H+)>c(OH-) | |
| C. | NaB溶液中:c(Na+)+c(H+)=c(HB)+c(B-) | |
| D. | HB的电离方程式为:HB═H++B- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定条件下,在容积不变的密闭容器内进行反应:2NO+2CO?N2+2CO2 △H<0.曲线a表示NO的转化率与反应时间的关系,若改变初始条件,使反应过程按照曲线b进行,可采取的措施是( )
在一定条件下,在容积不变的密闭容器内进行反应:2NO+2CO?N2+2CO2 △H<0.曲线a表示NO的转化率与反应时间的关系,若改变初始条件,使反应过程按照曲线b进行,可采取的措施是( )| A. | 加催化剂 | B. | 降低温度 | C. | 增大NO的浓度 | D. | 缩小容器体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠、镁等金属着火,不可用CO2灭火 | |
| B. | 在气体发生装置上点燃氢气等气体时,必须先检验气体的纯度 | |
| C. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| D. | 给试管中的液体加热时,不停沿试管倾斜方向移动试管或加入碎瓷片,以免液体暴沸伤人 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气能与大多数金属化合,其一般将变价金属氧化至最高价 | |
| B. | 干燥的氯气和氯水均能使鲜花褪色 | |
| C. | 除去氯气中少量氯化氢可使气体通过饱和食盐水 | |
| D. | 因为氯气有毒,所以可用于杀菌、消毒、漂白 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com