
| 时间/min | C(N2)/mol.L-1 | C(H2)/mol.L-1 | C(NH3)/mol.L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
分析 (1)放电时,该装置是原电池,正极上得电子发生还原反应,充电时,该电极应与电源的正极相连;
(2)根据盖斯定律进行判断;
(3)先计算氮气的反应速率,再根据氮气和氢气之间的关系计算氢气的反应速率;先计算5min时氢气的浓度,根据氮气、氢气和氨气浓度变化确定反应条件;
解答 解:(1)放电时,正极上NiOOH得电子和水反应生成氢氧化镍和氢氧根离子,电极反应式为:NiOOH+e-+H2O=Ni(OH)2+OH-,充电时,该电极应与电源的正极相连,
故答案为:NiOOH+e-+H2O=Ni(OH)2+OH-,正;
(2)N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1①
2H2(g)+O2(g)=2H2O(l);△H=-572kJ•mol-1②
将方程式②×3-①×2得目标方程式,4NH3(g)+3O2(g)=2N2(g)+6H2O(l);△H=-1531.2kJ•mol-1,
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l);△H=-1531.2kJ•mol-1;
(3)0~5min,N2的平均反应速率v(N2)=$\frac{(0.6-0.48)mol/L}{5min}$=0.024mol/L.min,v(H2)=3v(N2)=0.072mol/Lmin,5-10min,氮气浓度的改变量大于前5min的改变量,说明反应速率增大,氮气的浓度在逐渐降低而反应速率在增大,那么改变的条件只能是加入催化剂,故选c,
故答案为:0.072mol/(L•min),c.
点评 本题考查原电池原理、盖斯定律、化学平衡等知识点,难度不大,掌握基础是解题关键.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
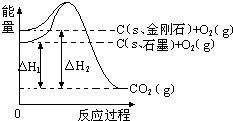
| A. | C(s、石墨)═C(s、金刚石)△H=+1.9kJ•mol-1 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | 石墨的稳定性强于金刚石 | |
| D. | 1mol石墨的总键能比1mol金刚石的总键能小1.9kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为避免船体遭受腐蚀,在船舶的外壳装上若干锌块,称为牺牲阳极的阴极保护法 | |
| B. | 原电池工作时,电流的方向由正极→负载→负极→原电池中电解质溶液→正极 | |
| C. | 白铁(镀锌铁)镀层破损后,铁皮依然受到保护 | |
| D. | 在铁制品上镀铜时,铁制品作电镀池的阳极,铜盐为电镀液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  比较非金属性强弱:S>C>Si 比较非金属性强弱:S>C>Si | B. |  分离CH3COOC2H5和饱和碳酸钠溶液 分离CH3COOC2H5和饱和碳酸钠溶液 | ||
| C. |  观察纯碱的焰色反应 观察纯碱的焰色反应 | D. |  比较Na2CO3和NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
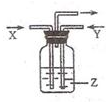 下列各组物质中.气体X和气体Y在通常条件下同时通入盛有溶液z的洗气瓶中(如图所示),一定没有沉淀生成的是( )
下列各组物质中.气体X和气体Y在通常条件下同时通入盛有溶液z的洗气瓶中(如图所示),一定没有沉淀生成的是( )| X | Y | Z | |
| A | NO2 | SO2 | BaCl2 |
| B | NH3 | O2 | Al2(SO4)3 |
| C | NH3 | CO2 | NaCl(饱和) |
| D | CO | O2 | Ca(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①③ | C. | ③ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com