
| A. | 苯、溴水、铁粉混合制成溴苯 | |
| B. | 甲烷与氯气光照制得纯净的一氯甲烷 | |
| C. | 乙烯通入溴的四氯化碳溶液得到1,2-二溴乙烷 | |
| D. | 用高锰酸钾溶液除去乙烷中的乙烯杂质 |
分析 A.苯和液溴在溴化铁作催化剂条件下发生取代反应生成溴苯;
B.甲烷和氯气在光照条件下发生取代反应生成多种氯代烃;
C.乙烯和溴发生加成反应;
D.乙烯能被酸性高锰酸钾溶液氧化生成二氧化碳.
解答 解:A.苯和液溴在溴化铁作催化剂条件下发生取代反应生成溴苯,苯和溴水不反应,故A错误;
B.甲烷和氯气在光照条件下发生取代反应生成多种氯代烃,所以得不到纯净物,故B错误;
C.乙烯中还有碳碳双键,性质较活泼,乙烯和溴发生加成反应生成1,2-二溴乙烷,故C正确;
D.乙烯能被酸性高锰酸钾溶液氧化生成二氧化碳,应该用溴水除去乙烷中的乙烯,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、除杂等知识点,明确实验原理及物质性质差异性是解本题关键,易错选项是D.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IV A | V A | VI A | VII A | O |
| 一 | A | |||||||
| 二 | B | C | ||||||
| 三 | D | E | F | G | H | I | ||
| 四 | K | J | ||||||
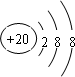 .
.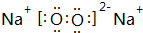 ,它属于离子(离子或共价)化合物.
,它属于离子(离子或共价)化合物.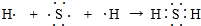 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
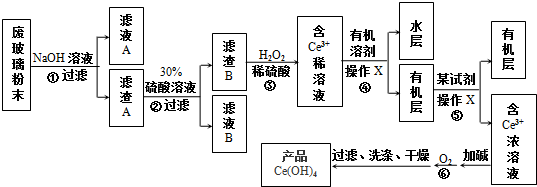
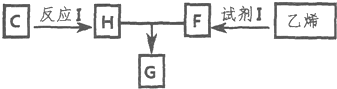
 (部分试剂和反应条件已略去).
(部分试剂和反应条件已略去).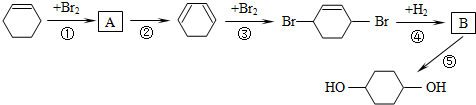
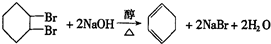
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+2H2O→CH4+2O2 | B. | NaOH+HCl=NaCl+H2O | ||
| C. | Cu+2HCl=Cu Cl2+H2↑ | D. | 4Al+3O2+6H2O=4Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 等质量的乙烷、乙烯、乙炔在氧气中完全燃烧,乙烷消耗的氧气最多 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 可向溴乙烷中加入硝酸银溶液检验溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅与氢氧化钾溶液反应:Si+2OH-+H2O═SiO32-+2H2↑ | |
| B. | Al(OH)3溶于稀硝酸:OH-+H+═H2O | |
| C. | 往氨水中加入少量AlCl3溶液:Al3++4OH-═[Al(OH)4]- | |
| D. | 把水玻璃滴入盐酸中:SiO32-+2H+═H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
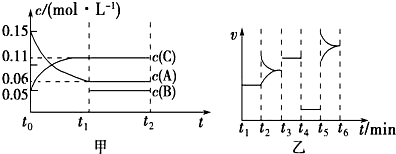
| A. | 若t1=15 s,t0~t1阶段B的平均反应速率为0.004 mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件是减小压强 | |
| C. | 该容器的容积为2 L,B的起始物质的量为0.02 mol | |
| D. | t5~t6阶段,容器内A的物质的量减少了0.06 mol,容器与外界的热交换为a kJ,则该反应的热化学方程式为3A(g)?B(g)+2C(g)△H=-50a kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
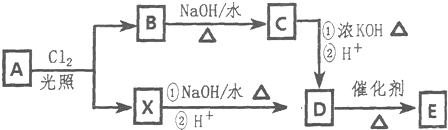
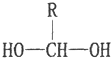 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$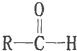

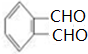 +4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$
+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$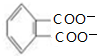 +2NH4++4Ag+6NH3+2H2O
+2NH4++4Ag+6NH3+2H2O .
. .
.
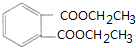 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com