
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系不正确的是
A.0.1 mol·L-1 CH3COONa溶液与0.1 mol·L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.等体积、等物质的量浓度的NaX和弱酸HX混合后呈酸性的溶液中:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
C.0.1 mol·L-1 Na2CO3溶液与0.1 mol·L-1 NaHCO3溶液等体积混合:3c(Na+)=2c(![]() )+2c(
)+2c(![]() )+2c(H2CO3)
)+2c(H2CO3)
D.0.1 mol·L-1 Na2C2O4溶液与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(![]() )+c(
)+c(![]() )+c(OH-)=c(Na+)+c(H+)
)+c(OH-)=c(Na+)+c(H+)
【答案】CD
【解析】
A.0.1 mol·L-1CH3COONa溶液与0.1 mol·L-1HCl溶液等体积混合所得溶液的溶质可以认为等物质的量的NaCl和CH3COOH,所以c(Na+)=c(Cl-),而醋酸为弱酸,难电离,所以c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-),故A正确;
B.等体积、等物质的量浓度的NaX和弱酸HX混合后溶液显酸性,所以HX的电离程度大于X-的水解程度,所以c(X-)>c(HX),而根据物料守恒可知2c(Na+)= c(X-)+c(HX),所以c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),故B正确;
C.0.1molL-1Na2CO3溶液与0.1molL-1NaHCO3溶液等体积混合,由物料守恒可知2n(Na)=3n(C),所以2c(Na+)=3c(![]() )+3c(
)+3c(![]() )+3c(H2CO3),故C错误;
)+3c(H2CO3),故C错误;
D.0.1molL-1Na2C2O4溶液与0.1molL-1HCl溶液等体积混合,由电荷守恒可知2c(![]() )+c(
)+c(![]() )+c(OH-)+ c(Cl-)=c(Na+)+c(H+),故D错误;
)+c(OH-)+ c(Cl-)=c(Na+)+c(H+),故D错误;
故答案为CD。


科目:高中化学 来源: 题型:
【题目】以食盐为原料进行生产并综合利用的某些过程如图:
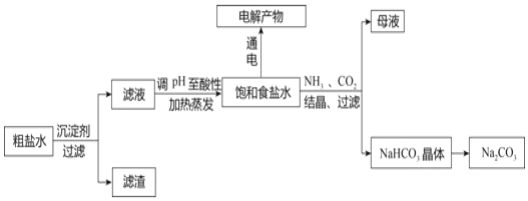
(1)除去粗盐中的微溶物质CaSO4通常用Na2CO3处理,请用平衡移动原理解释说明:____。
(2)人们习惯上把电解饱和食盐水的工业叫做氯碱工业。图1表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:
检验Y电极反应产物的方法是_____。电解NaCl溶液的离子方程式是____。
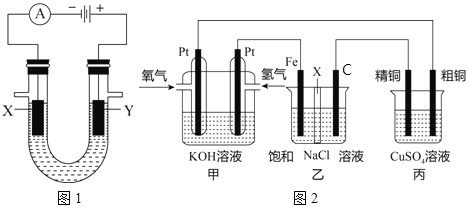
(3)某同学设计一个燃料电池(如图2所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
①通入氢气电极的反应式为____。
②石墨电极为_____(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,_____区(填“铁极”或“石墨极”)的溶液先变红。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将____(填“增大”“减小”或“不变”)。
④若在标准状况下,有224mL氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为_____L;丙装置中阴极析出铜的质量为_____g。(铜的摩尔质量为64)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用实验器材(规格和数量不限,省略夹持装置),能够完成相应实验的有几项( )
实验器材 | 相应实验 | |
① | 量筒、温度计、烧杯、碎纸条、盖板 | 中和热的测定 |
② | 烧杯、分液漏斗 | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇 |
③ | 量筒、玻璃捧、烧杯、100mL容量瓶 | 用浓盐酸配制100mL0.1molL-1的稀盐酸溶液 |
④ | 烧杯、酸式滴定管、碱式滴定管、锥形瓶 | 用H2SO4标准液滴定未知浓度的NaOH溶液 |
⑤ | 蒸馏烧瓶、酒精灯、温度计、直形冷凝管、锥形瓶、牛角管、石棉网 | 分离甲醇和甘油的混合物 |
⑥ | 坩埚、酒精灯、玻璃棒、泥三角、三脚架 | 从食盐水中得到NaCl晶体 |
A.2项B.3项C.4项D.5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如下:
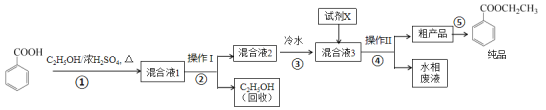
试剂相关性质如下表:
苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
常温性状 | 白色针状晶体 | 无色液体 | 无色透明液体 |
沸点/℃ | 249.0 | 78.0 | 212.6 |
相对分子量 | 122 | 46 | 150 |
溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
(1)为提高原料苯甲酸的纯度,可采用的纯化方法为_________。
(2)步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入 12.2 g纯化后的苯甲酸晶体,30 mL无水乙醇(约0.5 mol)和3 mL浓硫酸,加入沸石,加热至微沸,回流反应1.5~2 h。仪器A的作用是_________;仪器C中反应液应采用_________方式加热。
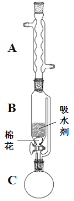
(3)随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为_________。
(4)反应结束后,对C中混合液进行分离提纯,操作I是_________;操作II所用的玻璃仪器除了烧杯外还有_________。
(5)反应结束后,步骤③中将反应液倒入冷水的目的除了溶解乙醇外,还有_____;加入试剂X为_____(填写化学式)。
(6)最终得到产物纯品12.0 g,实验产率为_________ %(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是五种常见的物质,其中A是能使带火星木条复燃的气体,B是单质,C是常见的无色液体,且跟日常生活密切相关,D 是淡黄色固体。在一定条件下,A~E五种物质的转化关系如图所示(部分反应条件已略去)。
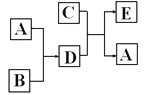
请回答下列问题:
(1)E的化学式___________;
(2)C与B反应的离子方程式_________________________;
(3)D与二氧化碳反应的化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,钠盐(Na2XO3)溶液中微粒浓度的变化关系如图所示[pOH=-lgc(OH-)]。下列说法正确的是

A.曲线N表示![]() 与pOH的变化关系
与pOH的变化关系
B.常温下,Ka2(H2XO3)=10-10
C.当pOH=2时, NaHXO3溶液中:![]()
D.向Na2XO3溶液中滴加稀盐酸至中性时,溶液中:c(Na+)=2c(HXO3-)+2c(XO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZrO2是重要的耐温材料,可用作陶瓷遮光剂。天然锆英石(ZrSiO4)含有铁、铝、铜等金属元素的氧化物杂质,工业以锆英石为原料制备ZrO2的工艺流程如下:

已知:Fe(SCN)3难溶于MIBK; Zr(SCN)4在水中溶解度不大,易溶于MIBK。
(1)锆英石中锆元素的化合价为____________。
(2)氯化主反应:ZrSiO4(s)+2C(s)+4Cl2(g) ![]() ZrCl4(g)+SiCl4(g)+2CO2(g) △H<0,ZrC14的产率随温度变化如图所示,由图可知氯化的最佳条件是_________。氯化过程ZrC14的产率随温度升高先增大后减小的原因是 __________。
ZrCl4(g)+SiCl4(g)+2CO2(g) △H<0,ZrC14的产率随温度变化如图所示,由图可知氯化的最佳条件是_________。氯化过程ZrC14的产率随温度升高先增大后减小的原因是 __________。

(3)写出A12O3高温氯化过程中转化为AlC13的化学方程式___________________;
(4)Na2S、H2S、NaCN等均为常用的铜沉淀剂,本流程使用NaCN除铜,不采用Na2S、H2S的原因是__________(用离子方程式解释)。若盐酸溶解后溶液中c(Cu2+)=0.01mol/L,当溶液中Cu2+开始沉淀时,c(CN-)= ___________。(已知Ksp[Cu(CN)2]=4.00×10-10)
(5)实验室进行萃取和反萃取的仪器是_______。流程中萃取与反萃取的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C9H12的苯的同系物,已知苯环上只有一个取代基,下列说法中正确的是 ( )
A. 该有机物能发生加成反应,但不能发生取代反应
B. 该有机物不能使酸性高锰酸钾溶液和溴水褪色
C. 该有机物分子中的所有原子不可能在同一平面上
D. 该有机物的一溴代物最多有5种同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com