
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V (盐酸)/mL(初始) | 0.00 | 0.20 | 0.10 | 0.10 |
| V (盐酸)/mL(终点) | 20.98 | 21.22 | 21.10 | 21.12 |
| 20.98+21.22-0.2+21.10-0.10 |
| 3 |
| 21.02-21 |
| 21 |
| ||
| ||
| 20.98+21.22-0.2+21.10-0.10 |
| 3 |
| 21.02-21 |
| 21 |
| 0.0105mol×84g/mol |
| 1.000g |


科目:高中化学 来源: 题型:
| A、2:3:2 |
| B、2:3:3 |
| C、1:3:2 |
| D、3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
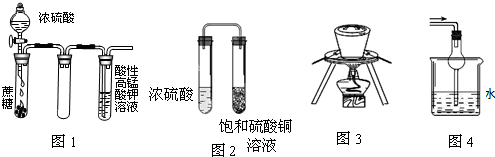
| A、图1酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去 |
| B、图2久置后,饱和硫酸铜溶液可能析出蓝色晶体 |
| C、图3在海带提碘实验中用于灼烧海带 |
| D、图4可用于吸收易溶于水的尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸式滴定管用蒸馏水洗涤后,又用标准液润洗 |
| B、滴定过程中锥形瓶中振荡,有液体溅出 |
| C、滴定完毕,滴定管尖端外挂有液滴 |
| D、滴定前仰视读数,滴定终点俯视读数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com