
【题目】在25 ℃时,有pH为a的HCl溶液和pH为b的NaOH溶液,取Va L该HCl溶液用该NaOH溶液中和,需Vb L NaOH溶液,问:
(1)若a+b=14,则Va∶Vb=___。
(2)若a+b=13,则Va∶Vb=___。
(3)若a+b>14,则Va∶Vb=___,且Va___Vb(填“>”“<”或“=”)。
(4).25 ℃时,将体积Va,pH=a的某一元强碱与体积为Vb,pH=b的某二元强酸混合。(书写步骤)
①若所得溶液的pH=11,且a=13,b=2,则Va∶Vb=________。
②若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b的值可否等于4________(填“可以”或“否”)
【答案】1 0.1 10a+b-14 > 1∶9 可以
【解析】
根据HCl与NaOH完全中和,溶液呈中性,则氢离子的物质的量=氢氧根的物质的量,据此解答。
根据强酸与强碱完全中和时,溶液呈中性,有n(H+)=n(OH-),即10-aVa=10b-14Vb,![]() =10a+b-14。
=10a+b-14。
(1)若a+b=14时, ![]() =100=1;答案为1。
=100=1;答案为1。
(2)若a+b=13时, ![]() =10-1=0.1;答案为0.1。
=10-1=0.1;答案为0.1。
(3)若a+b>14时, ![]() =10a+b-14,因为a+b>14,则
=10a+b-14,因为a+b>14,则![]() =10a+b-14>100=1,即Va>Vb;答案为10a+b-14,>。
=10a+b-14>100=1,即Va>Vb;答案为10a+b-14,>。
(4)①混合后溶液pH为11,说明碱过量,由a=13,b=2,则过量氢氧根浓度为10-3mol/L,强酸强碱中和后,OH-的浓度为:10-3=![]() , 99Va=11Vb,则
, 99Va=11Vb,则![]() =1∶9;答案为1:9。
=1∶9;答案为1:9。
②25℃时,将体积Va,pH=a的某一元强碱与体积为Vb,pH=b的某二元强酸混合,若b=4,酸溶液中c(H+)=10-4molL-1,b=0.5a,a=8,碱溶液中c(OH-)=10-6molL-1,则恰好中和,则有n(OH-)=n(H+),10-6×Va=10-4×Vb,![]() =
=![]() =102>1,符合Va>Vb,所以可以;答案为可以。
=102>1,符合Va>Vb,所以可以;答案为可以。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示。
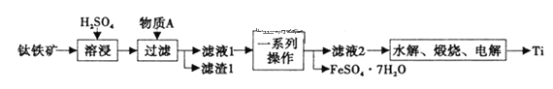
(1)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为___。
(2)物质A为___(填化学式),“一系列操作”为___。
(3)“水解”步骤中生成TiO2·xH2O,为提高TiO2·xH2O的产率,可采取的措施有___、___。(写出两条)。
(4)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式___;若反应后的溶液中c(Fe2+)=2×10-6mol·L-1,则溶液中c(CO32-)=___mol·L-1。(已知:KSP(FeCO3)=2.025×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积恒定的密闭容器中,1 mol A(g)与1 mol B(g)在催化剂作用下加热到500 ℃发生反应:A(g)+nB(g)![]() C(g)+D(g) ΔH>0达到平衡,下列判断正确的是( )
C(g)+D(g) ΔH>0达到平衡,下列判断正确的是( )
A.升高温度v(正)增大,v(逆)减小,平衡向正反应方向移动
B.平衡后再加入1 mol B,上述反应的ΔH增大
C.当n<1时,通入惰性气体,压强增大,平衡向逆反应方向移动
D.若n=1且A的转化率为50%,则平衡常数等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几种有机物:
A.![]() B.
B.![]() C.
C.![]() D.CH2 = CH—CH = CH2E.环戊烷
D.CH2 = CH—CH = CH2E.环戊烷
(1)上述有机物中互为同系物的是_____________,互为同分异构体的是____________。
(2)用系统命名法对B进行命名____________________________________。
(3)A与Cl2反应的类型为_____________;D使溴水褪色的反应类型为___________。
(4)B发生加聚反应的化学方程式为 ____________________________________。
(5)如图表示的是一种叫做双烯合成的有机反应,请写出B与D发生双烯合成所得产物的结构简式__________________。
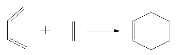
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备K2FeO4的实验装置图,其中甲为制氯气的装置。(资料:K2FeO4为紫色固体,微溶于KOH,具有强氧化性)
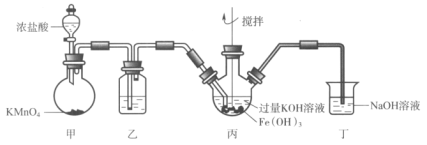
下列说法不正确的是( )
A.乙中所用试剂为饱和食盐水
B.丙和丁中均会发生反应:Cl2+2OH-=Cl-+ClO-+H2O
C.丙中产生紫色固体,说明碱性条件下,Cl2氧化性强于K2FeO4
D.若取反应后丙中紫色溶液,加入稀硫酸产生Cl2,则证明了K2FeO4具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 1.0molL﹣1盐酸跟50 mL 1.1 molL﹣1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是___________。

(2)大烧杯上如不盖硬纸板,对求得中和热数值的影响是_____(填“偏高”“偏低”或“无影响”)。
(3)如果改用60 mL 1.0 molL﹣1盐酸跟50 mL 1.1 molL﹣1氢氧化钠溶液进行反应,则与上述实验相比,所放热量_____(填“增加”“减少”或“不变”);所求中和热数值_____(填“增加”“减少”或“不变”)。
(4)_____(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液。
(5)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2﹣t1)/℃ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
已知盐酸、NaOH溶液密度近似为1.00 gcm﹣3,中和后混合液的比热容c=4.184×10﹣3kJg﹣1℃﹣1则该反应的中和热为△H=_____(保留小数点后一位)。
(6)上述实验数值结果与57.3 kJmol﹣1有偏差,产生偏差的原因可能是_____(填字母)。
a.实验装置保温、隔热效果差 b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物的叙述正确的是( )
A.丙烷的二卤代物是4种,则其六卤代物是2种
B.某烃的同分异构体只能形成一种一氯代物,其分子式一定为C5H12
C.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
D.对二甲苯的核磁共振氢谱显示有3种不同化学环境的氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )
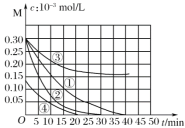
实验编号 | 温度℃ | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15 min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验④说明M的浓度越小,降解的速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1) 化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
已知:2NO(g)=N2(g)+O2(g) △H=-177kJ/mol
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) △H=-1253.4kJ/mol
则用NH3处理NO生成氮气和气态水的热化学方程式为___________________。
(2)已知:N2(g)+3H2(g) ![]() 2NH3(g) △H<0。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
2NH3(g) △H<0。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
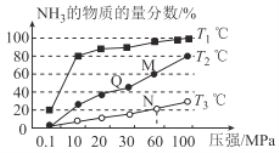
①M点的v正_________Q点的v正(填“>”“<”或“=”)。
②T3温度下,将1molN2和3molH2充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,反应的浓度平衡常数K=_____________ (用最简分数表示),M点的平衡常数比N点的平衡常数_________(填“大”“小”或“相等”)。
(3)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图所示。写出总反应化学方程式:_____________。


②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如上图所示。点B剩余NaClO含量低于点A的原因是____。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是__________。
(4)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如题图所示。若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为_____mol。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com