
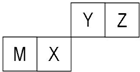
| A、M的离子半径小于Z的离子半径 |
| B、M和Y的最高价氧化物对应水化物之间能相互反应 |
| C、X的单质可以做光导纤维和半导体材料 |
| D、常温下,0.01mol/L的Y的气态氢化物的水溶液的pH=12 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
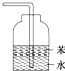 下列说法正确的是( )
下列说法正确的是( )| A、明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
| B、在Ca(ClO)2溶液中通入CO2,溶液一定变浑浊 |
| C、AgCl、AgBr、AgI均有感光性,其中AgI可用于人工降雨 |
| D、用如图所示装置吸收HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原溶液一定不存在较大浓度的H+、Mg2+ |
| B、原溶液确定含NH4+、NO2-、CO32-,且物质的量之比为5:2:1 |
| C、不能确定原溶液是否含有K+、NO3- |
| D、实验中产生的棕色气体遇空气颜色会加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
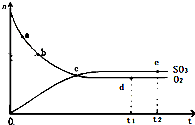 对于密闭容器中的反应:2SO2(g)+O2(g)?2SO3(g)△H<0,450℃时,n(SO3)和n(O2)随时间的变化关系如图所示,下列说法正确的是( )
对于密闭容器中的反应:2SO2(g)+O2(g)?2SO3(g)△H<0,450℃时,n(SO3)和n(O2)随时间的变化关系如图所示,下列说法正确的是( )| A、点c处反应达到平衡 |
| B、点a的正反应速率比点b的大 |
| C、点d(t1时刻)和点e(t2时刻)处n(SO2)不一样 |
| D、其他条件不变,600℃时反应至t1时刻,n(SO3)比上图中的d点值要大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、全部 | B、①②③④⑤ |
| C、③④⑤⑥ | D、①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
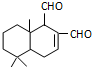 某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( )
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( )| A、Br2的CCl4溶液 |
| B、Ag(NH3)2OH溶液 |
| C、HBr |
| D、H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
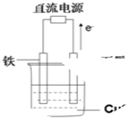 如图所示实验装置中,如果起始时盛有2000mL硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的c(H+)增加0.1mol/L,此时可观察到的现象是
如图所示实验装置中,如果起始时盛有2000mL硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的c(H+)增加0.1mol/L,此时可观察到的现象是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com