
【题目】运用化学反应原理的有关知识回答下列问题:
(1)晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s)△H=-989.2 kJ·mol-1,有关键能数据如下表:
化学键 | Si-O | O=O | Si-Si |
键能kJ·mol-1 | X | 498.8 | 176 |
则X的值为_________。
(2)加热N2O5,依次发生的分解反应为①N2O5![]() N2O3+O2,②N2O3
N2O3+O2,②N2O3![]() N2O+O2,在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L,则t℃时反应①的平衡常数为_________。
N2O+O2,在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L,则t℃时反应①的平衡常数为_________。
【答案】460 8.5mol/L
【解析】
(1)根据△H=反应物的总键能-生成物的总键能分析;
(2)设分解的N2O3物质的量为x,反应过程中共生成N2O3(x+1.7)mol,在①反应中N2O5分解了(x+1.7)mol,同时生成O2(x+1.7)mol.在②反应中生成氧气xmol。则(x+1.7)+x=4.5,求得x=1.4mol,平衡时N2O5、N2O3、O2浓度依次为c(N2O5)=(4-1.4-1.7)mol÷1L=0.9mol/L、c(N2O3)=1.7mol/L、c(O2)= 4.5 mol/L,带入平衡常数表达式,据此计算。
(1)已知Si(s)+O2(g)=SiO2(s)△H=-989.2 kJ·mol-1,1mol晶体硅中含有2molSi-Si,1molSiO2中含有4molSi-O,1molO2中含有1molO=O,则2×176+498.8-4x=-989.2,解得x=460;
(2)设分解的N2O3物质的量为x,反应过程中共生成N2O3(x+1.7)mol,在①反应中N2O5分解了(x+1.7)mol,同时生成O2(x+1.7)mol,在②反应中生成氧气xmol。则(x+1.7)+x=4.5,求得x=1.4mol,因此平衡时N2O5、N2O3、O2浓度依次为c(N2O5)=(4-1.4-1.7)mol÷1L=0.9mol/L、c(N2O3)=1.7mol/L、c(O2)= 4.5 mol/L,
反应①的平衡常数K=![]() =8.5mol/L。
=8.5mol/L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化学小组探究铜与硝酸反应的快慢及产物。
(1)实验甲:将铜片放入盛有稀HNO3的试管中,开始无明显现象,后逐渐有小气泡生成,该气体是______。在液面上方出现浅红棕色气体,溶液呈蓝色。
(2)实验乙:铜与浓HNO3反应,装置、现象如下:
实验装置 | 实验现象 |
| A中:最初反应较慢,随后加快,反应剧烈;产生红棕色气体;溶液呈绿色。 B中:溶液呈淡蓝色。 |
①A中铜与浓HNO3产生红棕色气体的化学方程式是 ______。
②实验现象“最初反应较慢,随后加快”的原因可能是 ______。
(3)有文献记载:铜与浓HNO3反应一旦发生就变快,是因为开始生成的NO2溶于水形成HNO2(弱酸,不稳定),它再和Cu反应,反应就加快。实验探究如下:
I:向 1 mL浓硝酸中加入几滴30% H2O2溶液、铜片,反应较慢,溶液呈蓝色。
II:向1 mL浓硝酸中加入几滴30% H2O2溶液,无明显变化。
①I中反应变慢的原因是 ______。
②NO2与H2O反应生成HNO2和 ______。
③对生成HNO2后反应变快的原因进行实验探究。
序号 | 实验操作 | 实验现象 |
III | 取B中溶液,加入一定量固体,再加入铜片 | 立即产生无色气体;液面上方呈红棕色 |
IV | 取B中溶液,放置一段时间,溶液变为无色后,再加入铜片 | 产生无色气体,较Ⅲ慢;液面上方呈浅红棕色 |
a.III中加入的固体为______。
b.IV中“放置一段时间”的目的是 ______。
实验III、IV可以说明,HNO2氧化Cu的反应速率比HNO3氧化Cu的反应快。
(4)化学小组同学结合实验甲、乙中HNO3被还原后的气体产物以及实验III的产物,综合上述实验,分析判断甲中反应慢的原因,除了硝酸起始浓度小、反应过程中温度较低外,另一个重要原因是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热法冶炼金属铬的矿渣中含有Cr2O7、Al2O3及少量Fe2O3,从中提取铬与铝有酸法和碱法两种工艺。请回答:
I.酸法。矿渣经硫酸浸取后,浸取液通过电沉积得到单质Cr;向剩余溶液中加碱回收得到Al(OH)3。
(1)为提高矿渣的浸取率,可采取的措施有_____(写出两点)。
(2)电沉积时,阴极的电极反应式为______________。
II. 碱法。工艺流程如下:
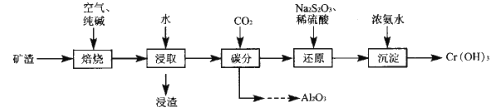
已知:①“焙烧”后固体成分为Na2CrO4、NaAlO2、NaFeO2。
②![]() 、Zn2+均可与EDTA1:1结合成络离子;Zn2+可与PAN1:1结合成紫红色络合物,且结合能力弱于EDTA。
、Zn2+均可与EDTA1:1结合成络离子;Zn2+可与PAN1:1结合成紫红色络合物,且结合能力弱于EDTA。
(3)浸渣的主要成分为Fe(OH)3。则“浸取”时发生反应的离子方程式为_________。
(4)“浸取”后所得溶液中Al的含量可用EDTA滴定法测定:
①取20.00mL浸取液于锥形瓶中,加入c1molL-1EDTA标准液V1mL(稍过量);
②依次用盐酸、醋酸钠—醋酸缓冲溶液调溶液至酸性,加热后滴入PAN指示剂;
③用c2molL-1ZnSO4标准液滴定至溶液恰好呈紫红色,消耗标准液V2mL。则“浸取”后所得溶液中Al的含量为_________gL-1(填计算式即可)。
(5)“碳分”时通入CO2后,通过_____ (填操作名称),即可得到纯净的Al2O3。
(6)“还原”时发生主要反应的离子方程式为__________。
(7)“沉淀”时,当c(Cr3+)≤10-5molL-1时,应调节溶液的pH至少为_________。(Ksp[Cr(OH)3]=1.0×10-32)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿比朵尔可用于合成一种治疗新型冠状病毒肺炎的试用药物,实验室以芳香化合物A 为原料合成阿比朵尔的一种合成路线如下:
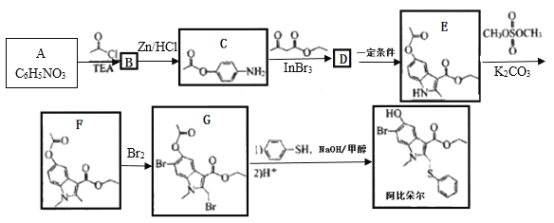
已知:![]()
请回答:
(1)A的化学名称为_________; B的结构简式为_________。
(2)阿比朵尔中含氧官能团的名称为________;由E生成F的反应类型为_______。
(3)由C生成D的化学方程式为___________。
(4)C的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器为 ___(填选项字母)。
A. 质谱仪 B. 红外光谱仪 C. 元素分析仪 D. 核磁共振仪
同时满足下列条件的C的同分异构体有_____种(不考虑立体异构)。
①苯环上连有-NH2 ②能发生水解反应和银镜反应
(5)参照上述合成路线,设计以苯和丁酮( ![]() ) 为原料制备
) 为原料制备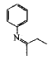 的合成路线(无机试剂任选):________________________________。
的合成路线(无机试剂任选):________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),正确的是( )
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度均降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1
③pH相等的四种溶液:a.CH3COONa;b.NaClO;c.NaHCO3;d.NaOH。其溶液物质的量浓度由小到大顺序为d、b、c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)= 2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
A.①②④B.③④⑥C.④⑤⑥D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,某同学探究硫代硫酸钠与酸反应速率的影响因素,设计了一系列如下实验:
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(molL-1) | V/mL | c/(molL-1) | V/mL | ||
A | 10 | 5 | 0.1 | 5 | 0.1 | 5 |
B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
C | 30 | 5 | 0.1 | 5 | 0.1 | 5 |
D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
(1)实验过程中为什么不用测量一定时间内放出SO2气体的量来表示该反应的化学反应速率大小________________________。
(2)若要探究温度对反应速率的影响,可以选择实验中的哪些组合来比较_______(填组号)。
(3)利用反应:I2+2Na2S2O3=Na2S4O6+2NaI可定量测定市售硫代硫酸钠的纯度,现称硫代硫酸钠固体样品配成溶液,取一定量溶液置于锥形瓶中,加入指示剂,用碘水滴定。回答下列各题:
①实验中滴定管应选择_________(填酸式或碱式)滴定管,滴定前可以选择_____作为指示剂,滴定终点时的现象为_________________。
②下列操作测得硫代硫酸钠的含量偏大的是(__________)
A.滴定前滴定管内有气泡,滴定后气泡消失
B.读取碘水体积刻度时,滴定前平视,滴定后俯视
C.滴定过程中,锥形瓶震荡过于剧烈,有少量溶液溅出
D.滴定管用蒸馏水洗净后,直接加入碘水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃、101 kPa时,反应能量转化关系如图所示,下列说法不正确的是

已知:C(s)+O2(g)===CO2(g) ΔH1;CO(g)+![]() O2(g)===CO2(g) ΔH2;
O2(g)===CO2(g) ΔH2;
A. ΔH2=-282.9kJ·mol-1
B. 2C(s)+O2(g)===2CO(g) ΔH=-221.2 kJ·mol-1
C. ΔH1>ΔH2
D. CO2(g)分解为C(s)和O2(g)是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除H2O外,含有CCl4、I2、I等)中回收碘,其实验过程如下:
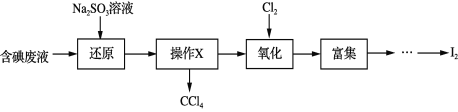
下列叙述不正确的是
A. “操作X”的名称为萃取,可在分液漏斗中进行
B. “还原”步骤发生的反应为:SO32+I2+H2O == 2I+SO42+2H+
C. “氧化”过程中,可用双氧水替代氯气
D. “富集”即I2富集于有机溶剂,同时除去某些杂质离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:
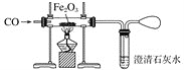
(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com