
| 1000ρω |
| M |
| n |
| V |
| 1000×1.83×98% |
| 98 |
| n |
| V |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| t2-t3 | t4-t5 | t5-t6 | t7-t8 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 180℃ |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
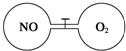 如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应(2NO+O2=2NO2).(不考虑NO2与N2O4的转化)
如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应(2NO+O2=2NO2).(不考虑NO2与N2O4的转化)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④ | B、②④ | C、⑤⑥ | D、④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com