
分析 (1)a.PM2.5是指大气中直径小于或等于2.5μm的颗粒物.它的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物;
b.PM2.5表面积大,具有吸附性,能吸附大量有毒物质;
c.胶体微粒直径在10-7m~10-9m之间,PM2.5粒子的大小不符合;
d.减少机动车尾气排放,减少了烟尘,能降低空气中PM2.5;
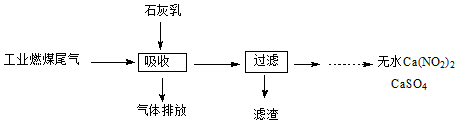
(2)①硫酸型酸雨形成过程是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸;
②尾气中SO2与氧气和石灰乳反应生成CaSO4和水;
③尾气中NO、NO2与石灰乳反应生成Ca(NO2)2和水,结合氧化还原反应的特征书写.
解答 解:(1)a.PM2.5是指大气中直径小于或等于2.5μm的颗粒物.它的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,故a正确;
b.PM2.5表面积大,具有吸附性,能吸附大量有毒物质,故b错误;
c.胶体微粒直径在10-7m~10-9m之间,PM2.5粒子的大小不符合,故c错误;
d.减少机动车尾气排放,减少了烟尘,能降低空气中PM2.5,故d正确;
故选:bc;
(2)①硫酸型酸雨形成过程是SO2溶于水生成亚硫酸,SO2+H2O?H2SO3;再被空气中的氧气氧化成硫酸,2H2SO3+O2═2H2SO4,
故答案为:SO2+H2O?H2SO3,2H2SO3+O2═2H2SO4;
②尾气中SO2与氧气和石灰乳反应生成CaSO4和水,反应方程式为:2SO2+O2+2Ca(OH)2═2CaSO4+2H2O故答案为:2SO2+O2+2Ca(OH)2═2CaSO4+2H2O;
③尾气中NO、NO2与石灰乳反应生成Ca(NO2)2和水,反应方程式为NO+NO2+Ca(OH)2═Ca(NO2)2+H2O;故答案为:NO+NO2+Ca(OH)2═Ca(NO2)2+H2O.
点评 本题考查了PM2.5、酸雨的形成、硫氮尾气的应用,难度不大,抓好基础是关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
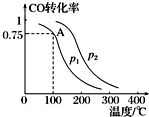 利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g)═CH3OH(g).一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示.
利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g)═CH3OH(g).一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
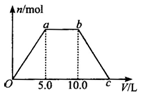 向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:
向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2O | CO | CO2 | H2 | |
| 甲 n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
| 乙 n/mol | 0.20 | 0.20 | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始物质的量mol | 4分钟后平衡时的物质量mol | 平衡时放出的热量/KJ | |
| I2 | H2 | HI | ||
| 甲 | 0.01 | 0.01 | 0.004 | Q1 |
| 乙 | 0.02 | 0.02 | a | Q2 |
| A. | 甲容器中,4分钟内氢气的反应速率为5.0×10-4rmol/(L•min) | |
| B. | 平衡时,放出的热量:Q1=4.0×10-3Q kJ | |
| C. | 平衡后,a=8.0×10-3mol,故乙中HI的质量分数比甲中高 | |
| D. | 该温度下,该反应的平衡常数K=0.25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com