
| A. | 原子最外层电子数为2的元素一定处于周期表IIA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5 | |
| C. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| D. | 同主族元素形成的氧化物的晶体类型均相同 |
分析 A.原子最外层电子数为2的元素有He、第ⅡA族元素、第ⅡB族元素等;
B.主族元素X、Y能形成XY2型化合物,可能有CO2、SO2、NO2、MgCl2、CaCl2等;
C.氟元素、氧元素一般没有正化合价;
D.C和Si位于同一主族,但为CO2分子晶体,SiO2为原子晶体.
解答 解:A.原子最外层电子数为2的元素有He、第ⅡA族元素、第ⅡB族元素等,不一定为ⅡA族,故A错误;
B.主族元素X、Y能形成XY2型化合物,可能有CO2、SO2、NO2、MgCl2、CaCl2等,原子序数之差可能为2、8、3或5等,故B正确;
C.氟元素、氧元素一般没有正化合价,其它短周期主族元素的最高化合价在数值上都等于该元素所属的族序数,故C错误;
D.C和Si位于同一主族,但为CO2分子晶体,SiO2为原子晶体,二者晶体类型不同,故D错误.
故选B.
点评 本题考查元素位置结构性质的相互关系,题目难度中等,本题注意把握元素的原子结构,做题时能举出反例.


科目:高中化学 来源: 题型:选择题
| A. | H2O与D2O互称同素异形体 | |
| B. | 1H与D互称同位素 | |
| C. | 氘(D)原子核外有1个电子 | |
| D. | 1H218O与D216O的相对分子质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
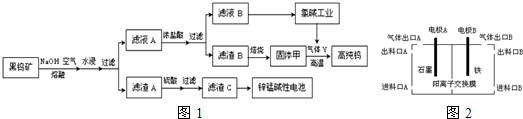
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溴水中滴入植物油,振荡后油层仍显无色,因此溴不溶于油脂 | |
| B. | FeCl3溶液可以腐蚀线路板上的Cu,因此Fe的金属活动性大于Cu | |
| C. | 常温下,2NO(g)+O2(g)=2NO2(g),因此该反应△H<0 | |
| D. | 相同浓度的Na2CO3溶液的碱性强于C6H5ONa,因此C6H5OH的酸性强于H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
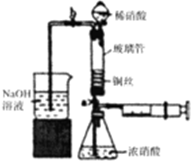 利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:
利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:| 实验编号 | 水温/℃ | 液面上升高度 |
| 1 | 25 | $\frac{2}{3}$ |
| 2 | 50 | 不足试管的$\frac{2}{3}$ |
| 3 | 0 | 液面上升超过实验1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6g 金属钠与足量乙醇反应放出2.24L氢气 | |
| B. | 50mL 18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| C. | 1mol羟基(-OH)中含电子数为10NA | |
| D. | 常温下,10L pH=12的Na2CO3溶液中含有的OH-离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol•L-1NaOH溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:A13+、Na+、NO3-、C1- | |
| C. | 在0.1 mol•L-1FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在$\frac{{c(H}^{+})}{{c(OH}^{-})}$=10-12的溶液中:K+、Na+、ClO-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com