
【题目】从下列事实所列出的相应结论正确的是 ( )
实 验 事 实 | 结 论 | |
A | Cl2的水溶液可以导电 | Cl2是电解质 |
B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->HAlO2或Al(OH)3 |
D | SO2通入KMnO4溶液,溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】因存在浓度差而产生电动势的电池称为浓差电池。利用如图所示装置进行实验,开始先闭合K2,断开Kl,一段时间后,再断开K2,闭合Kl,形成浓差电池,电流计指针偏转(Ag+浓度越大,氧化性越强)。下列说法不正确的是
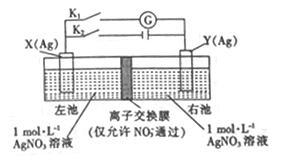
A. 闭合K2,断开Kl一段时间后,X电极质量增加
B. 闭合K2,断开Kl一段时间后,右池c(AgNO3)增大
C. 断开K2,闭合K1, X 电极发生氧化反应
D. 断开K2,闭合K1, NO3-从左池向右池移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学对教材中铜与浓硫酸的实验作了如下改进。实验装置如图所示(加热和夹持装置己略去)。
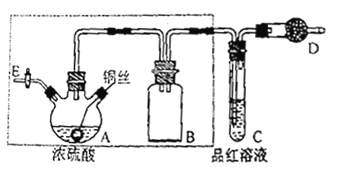
实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A,观察C中溶液颜色变化;
③将铜丝上提离开液面,停止加热。
(1)检査虚线框内装置气密性的方法是____________________。
(2)仪器A的名称是_________________,仪器B的作用是_________________,仪器D中所盛药品是_________________。
(3)装置A中发生反应的化学方程式为_________________。
(4)实验后,拆除装置前,为避免有害气体的泄漏,应当采取的操作是_______________。
(5)实验后仪器A中有白色固体产生,将仪器A中固液混合物缓慢转移至盛有少量水的烧杯中,可观察到的现象是_____________,用所得溶液做焰色反应实验时,观察到的火焰颜色为___________。不可直接向仪器A中加水的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2 3H2O晶体和SOCl2制备少量无水Cu(NO3)2。已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
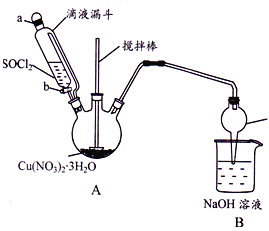 .
.
(1)①仪器c的名称是_________________。
②向三颈烧瓶中缓慢滴加SOC12时,需打开活塞_________(选填“a”、“b”或“a 和 b”)。
(2)装置A中Cu(NO3)2 3H2O和SOC12发生反应的化学方程式是________________。
(3)装置B的作用是________________。
(4)实验室以含铁的铜屑为原料制备Cu(NO3)2 3H2O的实验方案如下:
![]()
己知几种离子生成氢氧化物沉淀的pH如下表
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 4.2 | 6.7 |
①步骤I中所用稀HNO3稍过量的目的是_____________。
②请补充完整由溶液I制备Cu(NO3)2 3H2O晶体的实验方案:
向溶液I中加入__________,冰水洗涤得到Cu(NO3)2 3H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(NOx)是大气主要污染物之一,请根据以下方法的选用回答相应问题:
I.利用CH4催化还原氮氧化物消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(l) △H=-662kJ/mol
4NO(g)+CO2(g)+2H2O(l) △H=-662kJ/mol
②CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol
N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol
其中①式的平衡常数为K1,②式的平衡常数为K2,则:(1) CH4 (g)+4NO (g)=2N2(g) + CO2 (g )+H2O (1)△H=_________ ;改反应的平衡常数K=_________(用含Kl、K2的代数式表示)。
II利用燃料电池的原理来处理氮氧化物是一种新方向。装置如图所示,在处理过程中石墨电极I上反应生成一种氧化物Y。
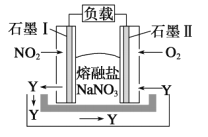
(2)写出氧化物Y的化学式_____________;
(3)石墨II电极为______(填“正”或“负”)极,该电极反应为______________;
Ⅲ.利用活性炭还原法处理氮氧化物。有关反应为C(s)+2NO(g)![]() N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
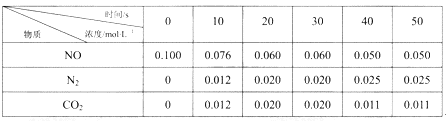
(4)该反应的平衡常数表达式K=_______,在0~10s内,N2的平均反应速率为______mol/(L·s),NO的转化率为________;
(5)30s后,改变某一条件,反应重新达到平衡,则改变的条件可能是________,若30s后升高温度至T2℃,平衡时,容器中NO的浓度由0.060mol/L变为0.072mol/L,则该反应的a___0 (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液生产硫酸和烧碱的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,下列有关说法正确的是
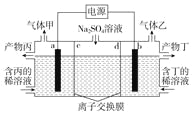
(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)
A. a电极反应式为2H++2e-===H2↑
B. 产物丙为硫酸
C. d为阴离子交换膜
D. Na2SO4溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在150℃时,NO2按下式发生分解反应2NO2![]() 2NO+O2 △H>0。向容积为1L的密闭容器中加入0.05molNO2在150℃时充分反应,达到平衡后测得c(NO)=0.04mol/L,吸收热量akJ。
2NO+O2 △H>0。向容积为1L的密闭容器中加入0.05molNO2在150℃时充分反应,达到平衡后测得c(NO)=0.04mol/L,吸收热量akJ。
(1)能说明上述反应已经达到化学平衡状态的是 。
A.容器内气体的颜色不再变化
B.容器内压强不再变化
C.容器内气体的密度不再变化
D.容器内气体的平均摩尔质量不再变化
E.v逆(NO2)=v正(NO)
F.相同时间内每消耗2个NO2分子的同时,生成2个NO分子
(2)下列有关该反应的图像中正确的是 。
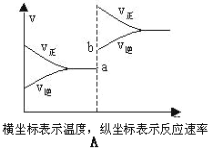
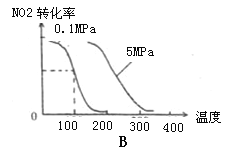
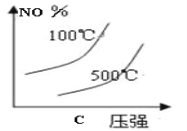
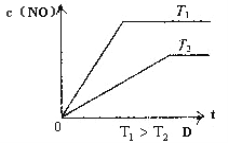
(3)若从反应开始至c(NO)=0.04mol/L共耗时5分钟,则用O2表示的平均反应速率为 。
(4)150℃时上述反应的平衡常数数值为 (可不写单位)。
(5)若在相同的容器内开始时只加入0.05molNO和0.025molO2,在相同的温度下充分反应达到平衡后,恰好放出akJ的热量,则此时O2的转化率为 。
(6)恒容条件下,下列措施中能使n(NO2)/ n(NO)增大的有 。
A.降低温度 B.充入He气
C.再充入1 mol NO (g)和0.5 mol O2(g) D.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草衍义》中有如下叙述:“嘉州峨眉山有燕萨石,形六棱而锐首,色莹白明澈。”这里“燕萨石”的主要成分可能是
A. SiO2 B. CaO C. NaCl D. C(石墨)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )。
A. 植物油氢化过程中发生了加成反应
B. 淀粉和纤维素互为同分异构体
C. 环己烷与苯可用酸性KMnO4溶液鉴别
D. 水可以用来分离溴苯和苯的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com